СНИПЫ В ТРЕТЬЕМ
ПОЛОЖЕНИИ КОДОНОВ ПРАКТИЧЕСКИ НЕ ВСТРЕЧАЮТСЯ В ГЕНАХ, ДЕТЕРМИНИРУЮЩИХ МУТАНТНЫЕ
БЕЛКИ
В.В. Соколик
ГУ «Институт неврологии, психиатрии и наркологии
АМН Украины», г. Харьков, Украина; sokolik67@rambler.ru
Теория накопления мутаций (Mutations
accumulation theory) в качестве предпосылок возникновения старения организма
была предложена еще в 1952 г. P.B. Medawar [1]. Эта теория предусматривает
увеличение с возрастом частоты генетических мутаций, которые остаются в
генофонде популяции. Поэтому особый интерес представляют снипы – single
nucleotide polymorphism (SNP)
в генах белков, агрегация которых обусловливает основные возраст-зависимые
конформационные болезни. Речь идёт о β-амилоидном пептиде (болезнь Альцгеймера),
α-синуклеине (болезнь Паркинсона) и хантингтоне (хорея Хантингтона).
Цель работы состояла в выявлении причин
специфического распределения SNP между нуклеотидами
триплетов в нуклеотидных последовательностях, детерминирующих в-амилоидный пептид
1-42, б-синуклеин и хантингтон.
В Protein Data
Bank присутствует информация о всех известных в настоящее время
мутациях для изучаемых белков (файлы UniProtKB/Swiss-Prot
P05067 (A4_HUMAN),
P37840 (SYUA_HUMAN)
и P42858 (HD_HUMAN)). В таблице 1 представлены эти данные.
Таблица 1
Мутации
в в-амилоидном пептиде 1-42, б-синуклеине и хантингтоне
|
№ |
SNP в кодоне
аминокислотного остатка |
Замена аминокислотного остатка |
Распределение замен нуклеотидов X,
Y и Z в триплете |
Конфигурация пептидной связи |
|||
|
X |
Y |
Z |
|||||
|
β-амилоидный пептид 1-42 |
|||||||
|
1 2 3 4 5 6 7 8 9 10 11 12 |
GCA → ACA CAU → CGU GAC → AAC AAA → GCA UUC → UCC GCA → GGA GAA → CAA GAA
→ GGA GAA
→ AAA GAU → AAU GCG → ACG GCG → GUG |
Ala 2 Thr His 6 Arg Asp 7 Asn Lys 16 Ala Phe 19 Ser Ala 21 Gly Glu 22 Gln Glu 22 Gly Glu 22 Lys Asp 23 Asn Ala 42 Thr Ala 42 Val |
G → A -- G → A A → G -- -- G → C -- G → A G → A G → A -- |
-- A → G -- A → C U → C C → G -- A → G -- -- -- C → U |
-- -- -- -- -- -- -- -- -- -- -- -- |
0 → 0 L → L R → R 0 → 0 R → R 0 → 0 0 → 0 0 → 0 0 → 0 L → L R → R R → R |
|
|
α-синуклеин |
|||||||
|
1 2 3 |
GCA → CCA GAG → AAG GCA → ACA |
Ala 30 Pro Glu 46 Lys Ala 53 Thr |
G → C G → A G → A |
-- -- -- |
-- -- -- |
0 → 0 R → R 0 → 0 |
|
|
хантингтон |
|||||||
|
1 2 3 |
UCU → UGU GAG → GCG GUA
→ AUA |
Ser 825 Cys Glu 1384
Ala Val 2788 Ile |
-- -- G → A |
C → G A → C -- |
-- -- -- |
L → L R → R 0 → 0 |
|
Примечание: R, 0 и L --
варианты конфигурации пептидной связи: правая, нулевая и левая, соответственно.
Обращает на себя внимание, что снипы в кодонах
генов известных мутантных белков распределяются преимущественно в дуплете
первых двух нуклеотидов триплета, ответственных за вариант аминокислотного
остатка, и практически не встречаются в третьем нуклеотиде. А именно, для β-амилоидного
пептида 1-42 58,3% SNP обнаружены в первом нуклеотиде мутантных
кодонов, 50% -- во втором и ни одного – в третьем; для α-синуклеина
выявлены SNP только в первом нуклеотиде; для хантингтона 33,3% -- в
первом и 66,7% -- во втором. Для всех трёх белков в третьем (воблеровском)
положении мутантных кодонов замены нуклеотидов не втсречаются, что говорит о
ведущей роли этого нуклеотида в обеспечении функциональности белка и
жизнеспособности организма в целом.
Как мы знаем, в своей Wobble гипотезе
неоднозначного спаривания кодон-антикодон для третьего нуклеотида триплета Crick
F.H. предположил, что для кодирования и трансляции
аминокислотного остатка достаточно дуплета первых двух нуклеотидов кодона.
Третий нуклеотид может быть любым: по гипотезе Crick F.Н.
он не участвует в кодировании аминокислотного остатка, а “воблирует” [2]. Тогда
отчего же оказывается так принципиальным для нативности белка третий нуклеотид
кодонов его аминокислотных остатков, если он их даже не кодирует.
При обсуждении аминокислотной последовательности
белка из понятия его первичной структуры невольно ускользает рассмотрение
пептидных связей между аминокислотными остатками. Подразумевают, что пептидные
связи качественно абсолютно одинаковые, а это не так. Введение понятия конфигурации пептидной связи (КПС) в
качестве основного, кодируемого в геноме третим нуклеотидом кодонов, элемента
пространственной структуры белка решает эту проблему. Правая (R),
нулевая (0) и левая (L) конфигурации пептидной
связи образуют ротамерные варианты в композиции смежных аминокислотных
остатков. При этом повторение в полипептиде R-конфигурации пептидной
связи
заставляет его аминокислотную цепочку сворачиваться в правую спираль без
какого-либо дополнительного участия боковых цепей аминокислотных остатков;
повторение 0-конфигурации – в в-тяж,
а повторение L-конфигурации – в левую спираль. Чередование R, 0
и L-конфигураций пептидных связей обусловливает неупорядоченный
участок аминокислотной цепи или выпетливание между фрагментами с вторичной
структурой [3].
Как же кодируется третим нуклеотидом кодонов
конфигурация пептидных связей белка? Автором данного исследования была
составлена таблица генетического кода
пространственной структуры белка (табл. 2), прототипом которой послужила эмпирическая
таблица композиционного генетического кода [4]. В таблице 2 каждому кодону
аминокислотного остатка поставлен в соответствие один из трёх вариантов
конфигурации пептидной связи (R, 0 или L).
Использование таблицы генетического кода
пространственной структуры белка дало возможность по детерминирующей их
нуклеотидной последовательности построить скелетный каркас последовательности
конфигураций пептидных связей, а также декодировать положение фрагментов
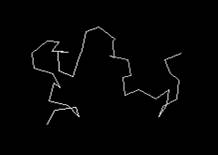
вторичной структуры интересующих нас белков. Визуализировать ход основной
полипептидной цепи, можно в графическом редакторе Ggenedit.exe.
Примеры скелетных каркасов (структурных шаблонов), построенных на основе
информации нуклеотидных последовательностей, для β-амилоидного пептида
1-42, α-синуклеина и хантингтона представлены на рис. 1. Важно отметить,
что мутации сгруппированные в таблице 1 не могут оказывать влияние на
пространственную структуру белков, представленную на рис. 1. Они лишь влияют на
адекватное функционирование этих белков. С другой стороны, локальное изменение
пространственной структуры белка, вызванное SNP в третьем положении
триплета нуклеотидов, привело бы к изменению конфигурации пептидной связи в
композиции смежных аминокислотных остатков и повлекло бы за собой необратимую
инактивацию белка.
Таблица 2
Генетический
код пространственной структуры белка
|
Y X |
C |
A.o. |
A |
A.o. |
U |
A.o. |
G |
A.o. |
Z |
КПС |
|
C |
CCC CCA CCU CCG |
Pro |
CAC |
His |
CUC CUA CUU CUG |
Leuл |
CGC CGA CGU CGG |
Argt |
C A U G |
R |
|
CAA |
Gln |
0 |
||||||||
|
CAU |
His |
L |
||||||||
|
CAG |
Gln |
R |
||||||||
|
A |
ACC ACA ACU ACG |
Thr |
AAC |
Asn |
AUC AUA AUU |
Ile |
AGC |
Serи |
C A U G |
R |
|
AAA |
Lys |
AGA |
Argb |
0 |
||||||
|
AAU |
Asn |
AGU |
Serи |
L |
||||||
|
AAG |
Lys |
AUG |
Met |
AGG |
Argb |
R |
||||
|
U |
UCC UCA UCU UCG |
Serл |
UAC |
Tyr |
UUC |
Phe |
UGC |
Cys |
C A U G |
R |
|
UAA |
T |
UUA |
Leuи |
UGA |
T |
0 |
||||
|
UAU |
Tyr |
UUU |
Phe |
UGU |
Cys |
L |
||||
|
UAG |
T |
UUG |
Leuи |
UGG |
Trp |
R |
||||
|
G |
GCC GCA GCU GCG |
Ala |
GAC |
Asp |
GUC GUA GUU GUG |
Val |
GGC GGA GGU GGG |
Gly |
C A U G |
R |
|
GAA |
Glu |
0 |
||||||||
|
GAU |
Asp |
L |
||||||||
|
GAG |
Glu |
R |
Примечание: КПС – конфигурация
пептидной связи; XYZ – первый,
второй и третий нуклеотиды в кодоне; R, 0, L – варианты конфигурации
пептидной связи; Т – стоп-кодон; Serл и Serи, Leuл и Leuи, Argt
и Argb – поворотные изомеры серина, лейцина и
аргинина, кодируемые различными дуплетами нуклеотидов кодонов, соответственно.
Таким образом, отсутствие SNP
в третьем положении кодонов генов белков, изученных в данной работе,
свидетельствует о том, что для нативной пространственной структуры белка
конфигурация пептидной связи является более значимой, чем вариант
аминокислотного остатка. Кроме этого, важно отметить, что организмы с
нарушениями пространственной структуры белка и полной утратой его функций
вследствие мутаций в третьем нуклеотиде их кодонов (изменение КПС)
выбраковуются ещё до рождения, поэтому в онтогенезе и старении принимают
участие только особи с мутациями в дуплете нуклеотидов, определяющих
аминокислотный остаток. Последние характеризуются снижением функции мутантных
белков, а следовательно и меньшей выживаемостью и продолжительностью жизни.
Мутантные формы рассмотренных в данном
исследовании белков кроме этого приобретают не свойственную им повышенную
способность к агрегации, что и является причиной таких медленно развивающихся
наследственных патологий накопления, как болезнь Альцгеймера, болезнь
Паркинсона или хорея Хантингтона. В предидущих работах мы показали, что в
основе агрегационной активности мутантных белков лежат специфические особенности
их структуры, а сам процесс агрегации носит цепной характер с затравкой в виде
белка-мутанта, рекрутирующего в агрегат немутантные молекулы белка [5-7].
|
β-амилоидный пептид 1-42 |
хантингтон |
||||
|
α-синуклеин |
Рис.
1. Пространственная структура β-амилоидного пептида 1-42, α-синуклеина
и хантингтона, декодированная по детерминирующим их нуклеотидным
последовательностям в соответствие с таблицей генетического кода
пространственной структуры белка и визуализированная в графическом редакторе Ggenedit.exe.
Литература
1.
Medawar P.B. An Unresolved
Problem in Biology // Lewis. — 1952.
2.
Crick F.Н. Codon-anticodon pairing: the wobble hypothesis. J. Mol. Biol.1966.
V.19. Р.548-555.
3.
Соколик В.В. Моделирование 3D-структуры
аполипопротеина Е3 по детерминирующей его нуклеотидной последовательности //
Материалы III Международной конференции «Актуальные проблемы биологии,
нанотехнологий и медицины». Тезисы докладов (1-4 октября 2009 г.),
Ростов-на-Дону. – С. 54.
4.
Кушелев
А.Ю., Полищук С.Е., Неделько Е.В. и др. Построение масштабной модели структуры
белка. Актуальные проблемы современной науки. 2002.
T.2. С.236—240.
5.
Соколик В.В. Моделирование
структурных предпосылок агрегации альфа-синуклеина // Материалы конференции
«Экстрапирамидные заболевания и возраст». Тезисы докладов (24-25 сентября 2009
г.), Киев. – С. 102—104.
6.
Соколик В.В. Принципы моделирования
3D-структуры белков-виновников возраст-зависимой конформационной патологии // Материалы
XIV Международной научно-практич. конференции «Пожилой больной.
Качество жизни» (1 – 2 октября 2009 г.), Москва. – Клиническая геронтология -
2009. - Т. 15, № 8-9. – С. 119.
7.
Соколик В.В. Структурные предпосылки
агрегации β-амилоидного пептида // Український вісник
психоневрології – 2009. – Т.17, вип.2(59).- С. 116—121.