|
Конкурс
по белкам
20020110 утро
П: Уважаемый Александр Юрьевич!
С 1974 г. я нахожусь в контакте с Л.Б.Меклером и Р.Г.Идлис. В истекшем году
помогал Лазарю Борисовичу, печатая и пересылая по электронной почте ряд его
деловых корреспонденций. Я в курсе причин, по которым факт овладения
Л.Б.Меклером алгоритмом фолдинга, по которому Природа строит белковые молекулы,
не получил пока всеобщего признания в мировой науке. Но речь не об этом.
Я с большим уважением отношусь к Вашему научному творчеству. Обратил внимание,
в частности, на Ваши с коллегами публикации по созданию компьютерной программы
построения структур белковых молекул. По моей наводке Р.Г.Идлис обратилась к
Вам с письмом, в котором просила Вас представить Ваш результат в сравнении с
рентгеноструктурным анализом (РСА) одной из молекул.Так как Ваш результат не
совпал со структурой РСА, деловой контакт, как я могу судить, по этой причне
прервался.
.
K: Я думаю, что контакт прервался по другой причине. Роза перестала писать
после моего письма, где я подробно аргументирую свою точку зрения.
Мое последнее письмо заканчивалось так:
"Поэтому, когда я вижу, что новая модель не совпадает со старой я никогда не
скажу, что она не работает. Это все равно, что сказать Копернику, что Ваша
модель солнечной системы не работает, потому что она не совпадает с системой
Птолемея. Так что для категоричных утверждений нужны убедительные аргументы... "
.
Вероятно, она до сих пор ищет эти убедительные аргументы. Меня это не смущает.
Дело в том, что я однажды писал Розе письмо. Она один или два раза ответила, а
потом перестала писать. Прошло несколько месяцев и я снова получаю от нее
письмо с просьбой прислать ей ссылку на ее статью из журнала "Природа", которую
я отсканировал и вставил в энциклопедию "Наномир". Так, что если ей что-то от
меня понадобится, я думаю, что переписка возобновится.
.
П: В истекшем году Л.Б.Меклер усиленно занимался так называемым "самоэкзаменом",
в ходе которого отработал технику построения из исходной бумажной ленточной
последовательности аминокислотных остатков (длиной 150 -170 а.о.) "жидкой"
и "твердой" трехмерной модели полипептида. Более того, он овладел техникой
построения из "твердой" конформации, (соответствующей модели, определяемой
РСА), "жидкой" модели, то есть той промежуточной конформации, которая не может
воспроизводиться существующими методами, но представляет особую ценность для
разработки новых вакцин и лекарств.
Построение из аминокислотной последовательности "жидкой" модели, а затем
построение из "жидкой" "твердой" модели, открывает путь выполнения заказов
формацевтических фирм, располагающих структурами моделей, полученных с помощью
РСА, но не располагающих очень полезными для них структурами "жидких" молекул.
Важно подчеркнуть, что выпонение таких заказов не сопровождается открытием
ноу-хау техники построения структур "твердых" моделей молекул из "жидких" и
наоборот "жидких" из "твердых". В этом факте заключена возможность
взаимовыгодного технического и коммерческого сотрудничества Вашей группы с
Л.Б.Меклером.
Поясню, как мне видится такая возможность.
1.Вы входите в Банк структур моделей РСА. Сообщаете линейные аминокслотные
цепочки нескольких таких структур Л.Б.Меклеру
2.Л.Б. Меклер строит трехмерные структуры этих молекул и сообщает Вам
результат, чтобы Вы убедились в его возможности строить "твердую" структуру
модели белковой молекулы из исходной аминокислотной последовательности.
3.Вы находите информацию о потребости формакологической фирмы об интересующей
ее структуре "жидкой" белковой молекулы и сообщаете Л.Б.Меклеру структуру
соотвтетствующей РСА модели и исходной последовательности аминокислотных
остатков.
4.Оформляется Договор о выполнении заказа формакологической фирмы на
изготовление для нее структуры "жидкой" модели. Предварительно оформляется
договор между Вашей группой и Л.Б.Меклером об условиях сотрудничества.
Я получил согласие Л.Б. Меклера обратиться к Вам. Но я не обсуждал с ним
предлагаемый мной план его сотрудничества с Вами.
В ожидании ответа для обсуждения возможных шагов.
С уважением. Павел Червонобродов.
Мой E-mail chervon@netvision.net.il Мой дом. тел. ***
.
K: Если честно, то мы не занимались связями с фармацевтическими фирмами. И
особого желания отвлекаться от чистой науки нам не хочется. Работать с
конкретными нуклеотидными последовательностями, строить (из пластмассы, в
виртуальном пространстве, в стандарте PDB) модели интересующие кого-либо мы
можем, причем это представляет для нас интерес в частности в целях рекламы
нашей программы CASP.exe, которую мы создали специально для участия в конкурсах
CASP и CAFASP.
Сам конкурс нам в каком-то смысле помог как стимул. Организаторы перепутали и
выставили наши данные по трехмерным структурам в базу двумерных структур, а
позднее просто вычеркнули нас из списка участников конкурса, вероятно, чтобы
упростить себе жизнь. Однако, факт участия в конкурсе CASP мы успели
зафиксировать в энциклопедии Наномир. Если Вам интересно, то загляните по
ссылке: http://ftp.decsy.ru/nanoworld/DATA/e_mail/20010111/cafasp.htm
Если Вам интересно сравнить модели Л.Б. Меклера с нашими, то нам это интересно.
Начать можно с любого белка, нуклеотидная последовательность которого известна.
Л.Б. Меклер строит свою модель, записывает вторичную структуру. Затем, мы
запускаем программу CASP.exe. Она строит в том числе вторичную структуру. Мы
эти две вторичные структуры сравниваем. Если они полностью совпадают, то
начинаем разговор о третичной структуре, если не совпадают, начинаем
разбираться, почему. Сами понимаете, если не сходятся интегралы, нужно
арифметику проверять...
.
Договора - дело не простое, поэтому я предлагаю найти профессионалов по
юридическим вопросам, которые за определенную плату взялись бы за юридическую
организацию нашего взаимодействия с Вами и фармацевтическими фирмами.
.
Александр Кушелев
(095) 977-23-24 (дом)
(095) 233-97-88 (мобильный)
.
nanoworld@bigfoot.com
.
.
.
20020110 вечер
П: Л.Б.Меклер строит модель из линейной последовательности аминокислотных
остатков. Я свидетель получения им письма от американского автора построения
трехмерной модели с использованием РСА, которому он послал одну из моделей,
представленных им на конкурс.В этом письме содержалось подтверждение
совпадения структуры модели Меклера со структурой, обнаруженной этим автором
способом РСА.
K: Этот факт мало повлияет на наше сотрудничество. Дело в том, что по моей
оценке интерпретация рентгеновских данных достоверна только для некоторых,
изученных и другими методами белков, например, для гемоглобина. Большинство
белков, где по рентгену разные лаборатории пытаются изображать альфа-спирали,
в действительности алфа-спиралей не содержат. В этом я убедился на 100%. Если
у Л.Б. Меклера совпал с рентгенологами лишь один белок, тем лучше для Л.Б.
Меклера. Если много, то плохо, т.к. для меня это означает, что совпали две
ошибочные системы интерпретации.
.
А сравнение наших методов лучше начинать с простого. Есть классические
структуры. Я предлагаю построить короткий участок двух белков, один из
которых принадлежит альфа-спиральным (керотин), а второй - фибриллярным
(фиброин). Оба участка по 22 аминокислотных остатка. Наконец, третий участок
из 22 аминокислотных остатков принадлежит лизоциму. Известно, что этот участок
белка замыкается в цикл через дисульфидный мостик.
.
Я предлагаю Л.Б. Меклеру построить три участка по 22 аминокислотных остатка, а
потом мы посмотрим какой из участков - альфа-спираль, какой - фиброин, а какой
замыкается в цикл через дисульфидный мостик.
.
1. Cys-Ala-Lys-Arg-Val-Val-Arg-Asp-Pro-Gln-Gly-Ile-Arg-Ala-Trp-Val-Ala-Trp-Arg-Asn-Arg-Cys
2. Cys-Ala-Ala-Ala-Gly-Ser-Gly-Ala-Gly-Ala-Gly-Ala-Gly-Tyr-Gly-Ala-Ala-Ser-Gly-Ala-Gly-Cys
3. Cys-Asn-Ala-Lys-Gly-Glu-Thr-Phe-Glu-Val-Ala-Leu-Ser-Asn-Lys-Gly-Glu-Tyr-Ser-Phe-Tyr-Cys
.
Эти три структуры я исследовал тщательно, сравнивал с рентгеновскими данными и
другими методами. Данные по ним я Вам пришлю после построения моделей Л.Б.
Меклером (для чистоты эксперимента). Если вторичная структура этих белков
получится, то можно говорить о третичной, т.е. о пространственной структуре
дальнего порядка. Если на вторичной структуре обнаружатся расхождения, то
придется разобраться, почему...
.
П: Чтобы продолжить разговор, предлагаю следующий шаг: из банка структур
РСА моделей Вы берете одну длиной около 150 аминокислотных остатков, строите с
помощью Вашей компьютерной програмы структуру этой белковой молекулы и
пересылаете таблицу, сопостовляющую Вашу структуру со структурой из Протеин
Банка.
Это будет означать, что Вы можете превращать линейные последовательности,
которые представляют собой расшифрованный Геном человека в трехмерные
структуры, соответствущие РСА, что на сегодня является критерием овладения
фолдингом.
.
K: Как только Л.Б. Меклер построит модели этих трех участков, я пришлю Вам
файлы EMBL (нуклеотидные последовательности) и PDB (интерпретация рентгена)
этих трех белков. Вы сами запустите программу CASP.exe, либо dne_to_ent.htm,
либо dne2ent.exe и посмотрите что выдает моя модель.
.
Для одной из последовательностей программа должна выдать альфа-спираль, для
другой - цикл, для третьей фибриллярную структуру.
.
После этого Вы сможете посоветоваться с Вашими специалистами и решить, как
хорошо совпадают с общепринятыми данными модели Л.Б. Меклера и модели, выданные
программой CASP.exe (две других программы: dne_to_ent.htm и dne2ent.exe
работают по тому же алгоритму, но не выводят вторичную структуру).
.
Я думаю, что такой вариант нашего сотрудничества будет более простым и
эффективным, чем работа с одним белком длиной 150 аминокислотных остатков.
.
С Уважением,
А.Кушелев
nanoworld@bigfoot.com
.
.
.
20020111
П: Уважаемый Александр Юрьевич!
Наступил момент, когда я должен обратиться с Л.Б.Меклеру с предложением о Вашем
с ним деловом контакте.
Однако, я знаю о его твердом представлении, что тысячи ренгеноструктурных
моделей, полученных способом РСА и находящихся в Протеин банке отражают научно
достоверный результат определения истинных структур молекул, находящихся в
кристаллическом состоянии ("твердых").
Я также знаю, что результаты построения Л.Б. Меклером перед взыскательными
оппонентами ряда моделей полипептидов (см., в частности, журнал "Природа" №5,
1993) , которые совпадали с результатами структур по РСА, трактуются им как
достоверный научный эксперимент, подтверждающий верность его теории.
Поэтому я предвижу резко отрицательное отношение Л.Б.Меклера на Ваше
утверждение "Если у Л.Б. Меклера совпал с рентгенологами лишь один белок, тем
лучше для Л.Б. Меклера. Если много, то плохо, т.к. для меня это означает, что
совпали две ошибочные системы интерпретации".
.
K: Да Вы не переживайте. Некоторые белки в Протеин-банке почти правильные.
Согласитесь, что смешно утверждать об истинности модели, находящейся в PDB,
если В 1995 году это была одна модель, в 1997 - сильно улучшенная, а в 2001
измененная до неузнаваемости по отношению к 1997 году. Можно, конечно, говорить,
что модель 2001 года более истинная, чем 1997г., но где гарантия, что модель
2002г. не будет более истинной, чем 2001г.?
.
П: Далее, я знаю от Л.Б.Меклера, что оценивать отдельные участки структуры
белковой молекулы надо только в контексте ее полного строения в "твердом"
трехмерном состоянии , то есь надо рассматривать те самые трехмерные модели,
которые находятся в упомянутом Банке структур моделей по РСА. Поэтому Ваше
предложение " Я предлагаю Л.Б. Меклеру построить три участка по 22
аминокислотных остатка, а потом мы посмотрим какой из участков - альфа-спираль,
какой - фиброин, а какой замыкается в цикл через дисульфидный мостик" также
встретит отрцателное отношение с его стороны.
.
K: - Это - не проблема. Высылаю полные последовательности (см. вложенные файлы
01.txt, 02.txt, 03.txt)
.
Меня интересуют только участки белков, т.к. моей программе не нужна вся
структура белка для определения вторичной структуры.
.
В белке
01.txt интересует участок с номерами аминокислотных остатков: 1...21
02.txt интересует участок с номерами аминокислотных остатков: 96...117
03.txt интересует участок с номерами аминокислотных остатков: 80...100
.
П: По изложенным соображениям я возвращаюсь к предложению: Вы строите с помощью
Вашей компьютерной програмы структуру белковой молекулы и пересылаете таблицу,
сопостовляющую Вашу структуру со структурой из Протеин банка.
Это будет означать, что Вы можете превращать линейные последовательности
аминокислотных остатков, которые представляют собой расшифрованный Геном
человека, в трехмерные структуры, соответствущие РСА, что на сегодня является
критерием овладения фолдингом. Добавлю, что от Л.Б. Меклера слышал утверждение,
что вторичные структуры не Объект интереса, ибо биологические машины трехмерны.
.
K: Если Вы хотите проверять работоспособность моей модели, то я Вам для этого
вообще не нужен. Заходите на сайт http://ftp.decsy.ru/nanoworld/index.htm
Входите в каталог "Программы". Скачиваете программу CASP.exe . Достаете из EMBL
нуклеотидную последовательность в виде файла с расширением DNE. Запускаете
программу CASP.exe. Открываете <имя файла>.dne . Программа CASP.exe создает
несколько файлов, в том числе .htm - вторичная структура и .ent - третичная,
которая верна лишь в ближнем порядке расположения аминокислотных остатков. Если
Вас интересует только третичная структура, то входите в раздел "Программы",
запускаете программу dne_to_ent.htm, заменяете входной файл-образец на
интересующий Вас файл.dne, нажимаете на кнопку "Convert" и сравниваете
полученную структуру.ent со структурой из PDB. Если что-то не будет получаться,
спрашивайте. Если Вы просто нажмете на кнопку "Convert", то увидите, как
работает программа с файлом-образцом (фрагментом белка лизоцима). Кстати, моими
программами уже давно пользуются в разных странах... Вы же сможете сами сделать
вывод о том, может ли программа CASP.exe или dne_to_ent.htm превращать
нуклеотидную последовательность (но не аминокислотную) во вторичные и третичные
(с оговоркой, что дальний порядок не воспроизводится) структуры, соответствующие
РСА.
.
Что касается высказывание Л.Б. Меклера о том, что вторичные структуры не
являются его объектом интереса, то в случае нашего сотрудничества придется
сравнить сначала именно вторичные структуры, т.к. если они не сойдутся, то о
третичных структурах будет рано говорить, точно так же, как бессмысленно
спорить об интегралах, дифференциальных уравнениях и о корнях квадратных
уравнений, если, простите за банальность, арифметика не сходится...
.
П: Не располагая такой информацией, я не могу продолжить попытку установления
контакта между Вами и Л.Б.Мек-лером, которая по моему представлению,
вынесенному из ознакомления с Вашим подкупающим меня стилем открытой дискуссии
и готовности к творческому общению, могла бы оказаться весьма плодотворной для
признания научным сообществом факта овладения Вами тайной фолдинга.
.
K: Я надеюсь, что Вы располагаете всей информацией для продолжения попытки
установления контакта Л.Б.Меклер - А.Ю.Кушелев. Если чего-то не хватает,
пишите, добавим.
.
Вкладываю три текстовых файла с полными аминокислотными последовательностями
белков, в которых меня интересуют участки альфа спирали, фибриллярной структуры
и цикла. Те, что я присылал ранее не имеют к этим отношения, т.к. я выбрал
более простые белки, чтобы не перегружать Л.Б.Меклера лишней работой.
.
С уважением
Павел Червонобродов
chervon@netvision.net.il
.
С уважением, А.Кушелев
nanoworld@bigfoot.com
.
.
.
20020112 10.00
П: Уважаемый Александр Юрьевич!
.
Признаюсь Вам, что одним из побудительных мотивов обращения к Вам, является
понимание, что я не владею навыками работы с программами и банками ( например
PDB), и если бы удалось реализовать мою инициативу по установлению контакта
Меклер - Кушелев, то это имело бы весьма полезные результаты для судьбы
проблемы фолдинга ( не Вам мне говорить, насколько это важная проблема).
.
K: Программа dne_to_ent.htm сделана как раз для таких пользователей, как Вы.
Для того, чтобы посмотреть, как она работает достаточно один раз кликнуть
мышкой на ссылке: http://ftp.decsy.ru/nanoworld/DATA/PROGRAMS/DNETOENT/DNE_TO_ENT.HTM
После этого на экране Вашего компьютера должны появиться два окна (входных
данных и выходных данных). В первом окне Вы увидите образец входных данных
(файл из EMBL, т.е. нуклеотидная последовательность белка лизоцима). Под этим
окном расположены три кнопки. Первая называется "Convert". Достаточно кликнуть
на ней мышкой и программа у Вас наглазах начнет конвертировать нуклеотидную
последовательность в координаты атомов в стандарте PDB (Протеин банка). Таким
образом, чтобы овладеть навыками работы с программой dne_to_ent.htm Вам
достаточно два раза нажать мышкой (один раз на ссылке, а второй раз на кнопке
"Convert". Согласитесь, что это гораздо проще, чем написать и отправить письмо
по электронной почте.
.
П: И поэтому я не могу использовать Ваши программы, чтобы убедиться в том, что
они позволяют, исходя из нуклеотидной последовательности, кодирующей любой
данный белок, построить модель его трехмерной структуры, идентичную модели,
полученной в результатте РСА его кристала, содержащейся в PDB,
.
Я буду Вам крайне признателен, если Вы покажете рядом структуры двух
моделей, - одну, которую Вы сами построите, пользуясь Вашей программой (для
любого избранного Вами белка, для которого есть соотвтетствующая модель в PDB),
и вторую, взятую из PDB. Желательно указать на этих моделях координаты их
составных элементов и точные границы элементов вторичной структуры, поскольку
Вас "интересуют только участки белков, т.к. моей программе не нужна вся
структура белка для определения вторичной структуры".
.
K: Мне не трудно показать Вам структуры двух моделей, т.к. они опубликованы в
научной статье, которую при желании Вы можете посмотреть целиком:
http://ftp.decsy.ru/nanoworld/DATA/TEXTS.RUS/20000509.htm
.
Я показываю Вам две структуры из этой статьи:
На примере белка "Cholesterol oxidase" покажем, как исходная нуклеотидная
последовательность этого белка из банка EMBL была преобразована в
композиционный код, а затем производилось сопоставление с данными из
брукхэвенского банка структур.
18 GGC Gly GLY 1
19 AGT Ser SER 3
20 GGA Gly GLY 2
21 TAC Tyr TYR 1 HELIX
22 GGC Gly GLY 1 HELIX
23 GGT Gly GLY 3 HELIX
24 GCC Ala ALA 1 HELIX
25 GTC Val VAL 1 HELIX
26 GCC Ala ALA 1 HELIX
27 GCG Ala ALA 4 HELIX
28 CTG Leu LEU 4 HELIX
29 CGG Arg ARG 4 HELIX
30 CTG Leu LEU 4 HELIX
31 ACG Thr THR 4 HELIX
32 CAG Gln GLN 1 HELIX
33 GCC Ala ALA 1
34 GGT Gly GLY 3
35 ATC Ile VAL 1
Номер
столбца Значение
1 номер аминокислотного остатка
2 триплет нуклеотидов, кодирующий данный остаток
3 название аминокислотного остатка (по коду)
4 название аминокислотного остатка (из банка структур)
5 вариант композиции (по Таблице композиционного кода (модель))
6 вариант композиции (из банка структур (PDB))
.
В этой таблице сравниваются вторичные структуры. О третичных структурах давайте
поговорим позже, т.к. без разбора вторичных структур мы потеряем много времени
на третичные. Согласитесь, что не усвоив материала первого класса начальной
школы не резон предпринимать попытки осваивать материал десятого класса или
университета...
.
П: Добавлю, что мне не понятна Ваша констатация - "Программа CASP.exe создает
несколько файлов, в том числе .htm - вторичная структура и .ent - третичная,
которая верна лишь в ближнем порядке расположения аминокислотных остатков".
И "... превращать нуклеотидную последовательность (но не аминокислотную) во
вторичные и третичные (с оговоркой, что дальний порядок не воспроизводится)
структуры, соответствующие РСА".
.
Если только в "ближнем порядке", и если "не воспроизводится дальний порядок",
то где же полное совпадение структур?
.
С уважением
Павел Червонобродов.
.
K: Начну с того, что программа CASP.exe - это автоматизированная система,
созданная для конкурса CASP и CAFASP. В ней заложены упрощенные алгоритмы. Эти
упрощенные алгоритмы могут точно воссоздавать вторичную структуру, но не
способны в полном объеме воссоздать третичную.
.
Для воссоздания третичной структуры белковой молекулы необходимо учитывать
физико-химические взаимодействия (гидрофобно-гидрофильные, водородные связи,
валентность, минимизация энергии, градиенты электронной плотности и многое
другое). В программе CASP.exe ничего из перечисленного не учитывается. В ней
заложен лишь геометрический алгоритм, который дает правильный результат для
ближнего порядка расположения атомов.
.
Мы можем получать дальний порядок расположения атомов, но это требует учета
вышеперечисленных факторов. В программу CASP.exe они не заложены. Мы получаем
дальний порядок другими способами, которые еще полностью не запрограммированы.
.
Для некоторых участков некоторых белков даже один геометрический алгоритм дает
точный результат для дальнего расположения атомов. Это можно видеть на примере
лизоцима:
http://ftp.decsy.ru/nanoworld/DATA/IMAGES/SLIDES/990709/demo.htm
.
Что касается общего случая, то он еще полностью не запрограммирован. В этом
ключе я хотел бы пожелать Л.Б. Меклеру написать программу, которая делала бы за
него ту часть работы, которую можно автоматизировать. Иначе ему придется
работать вместо компьютера...
.
Что касается Вашей фразы о "полном совпадении структур", то мы (лаборатория
Наномир) и я (А.Кушелев), в частности, не стремимся полностью совпадать с
моделями других авторов, которые интерпретируют данные РСА, т.к. мы уже
достоверно установили, что в этих данных содержится большой процент ошибок.
Как я уже писал, многие белки, где до настоящего времени интерпретаторы РСА
"видят альфа-спирали", в действительности их нет.
.
Ваше желание видеть "точные границы элементов вторичной структуры" в
интерпретации РСА в принципе неосуществимо, т.к. РСА имеет погрешность.
Представьте себе, что Вы пользуетесь РСА, который ошибся в пространстве на
пару ангстрем. При такой ошибке Вы попали на соседний атом. Этот атом
принадлежит другому аминокислотному остатку. Этот остаток принадлежит другой
альфа-спирали и т.д. и т.п. Даже если объект исследования РСА - маленький
белок, состоящий из короткой альфа-спирали, разделенной единичными
аминокислотными остатками-"поворотами", то ошибка РСА в пару ангстрем может
привести к ошибке на виток альфа-спирали, т.е. на 4 аминокислотных остатка в
линейной последовательности.
.
Зачем же я буду стремиться к ошибке в 4 аминокислотных остатка, если точность
моей модели - 2 пикометра, что 100 раз выше самых достоверных данных РСА?
.
Если у Вас появились новые вопросы, - не стесняйтесь, задавайте. Мне очень
интересно на них отвечать, т.к. в процессе нашей дискуссии я обнаруживаю, что в
энциклопедии Наномир не хватает подробных описаний, которые я даю Вам и
одновременно 30 000 читателей, которые ежегодно посещают сайт:
http://ftp.decsy.ru/nanoworld/index.htm
.
С уважением,
А.Кушелев
nanoworld@bigfoot.com
.
.
.
20020112 13.48
П: Уважаемый Александр Юрьевич!
.
Из Вашей информации у Л.Б.Меклера возник вопрос, который по моей просьбе он
сформулировал. Привожу его ниже. Что касается моих вопросов и комментариев, то
это потом.
.
"Вы утверждаете, что третья буква нуклеотидной последовательности (триплета)
согласно генетическому коду, кодирующему аминокислотные остатки биологической
значимости, определяют способность данного аминокислотного остатка быть
элементом либо альфа-спирали (спирали 3-10), либо бета-нити, либо омега петли,
либо изгиба.
.
Будьте добры, сообщите пожалуйста, какая из букв четырех кодонов глицина
определяет указанную способность глицина. Какая, например, валина, какая,
например, аргенина или серина?
.
K: Например, для глицина:
GGC Альфа-спираль (4/10)
GGA бета
GGT бета-поворот
GGG альфа-спираль (3/10)
.
Остальные можно посмотреть в таблице композиционного генетического кода:
http://ftp.decsy.ru/nanoworld/DATA/TEXTS.RUS/9990520.htm
.
П: А как быть с триптотофаном или с метионином, каждый из которых кодируется
лишь одним кодоном.?,
А как быть с тирозином или с цистеином, или с фениалонином, каждый из которых
кодируется только двумя кодонами?
.
K: Это все Вы найдете в таблице композиционного генетического кода.
.
П: Элементами каких вторичных структур могут быть данные аминокислотные остатки
или, может быть вообще никаких?
.
K: Отвечаю прямо: любых, т.к. по таблице их ставит рибосома, а потом они могут
перестроиться за счет химических взаимодействий.
.
П: Буду чревычайно признателен за прямые ответы на прямые вопросы, без ссылок
на соответствующие файлы".
.
С уважением
Павел Червонобродов.
.
K: Если Вы не можете посмотреть таблицу через ссылку в Internet, то я вышлю Вам
ее в виде вложения в письмо, а если Вы не можете смотреть вложенные файлы
(напишите, если так), то я вставлю всю таблицу в текст письма.
С уважением,
А.Кушелев
nanoworld@bigfoot.com
.
.
.
20020112 15.00
П: Уважаемый Александр Юрьевич!
По указанному Вами адресу в этом сообщении и адресам в предыдущем вход в
Интернет у меня не получился. Я взял приводимую ниже Вашу таблицу из ранее
мной переснятого Вашего файла. Прежде чем сообщить Л.Б.Меклеру продолжение
ответа на его вопрос, прошу подтвердить верность этой таблицы или в противном
случае сообшить ту, на которую Вы ссылаетесь ниже в этом сообщении.
.
П. Ч.
9920204 Таблица генетического композиционного кода (науч.)
.
Код Амино- Компози- Белок Номер
кислотный ционный остатка
остаток угол
UUU Phe Кси ? Миоглобин 33,106,123
***
***
.
20020112 15.30 K:
.
.
.
П: Уважаемый Александр Юрьевич!
По указанному Вами адресу в этом сообщении и адресам в предыдущем вход в
Интернет у меня не получился. Я взял приводимую ниже Вашу таблицу из ранее
мной переснятого Вашего файла. Прежде чем сообщить Л.Б.Меклеру продолжение
ответа на его вопрос, прошу подтвердить верность этой таблицы или в противном
случае сообшить ту, на которую Вы ссылаетесь ниже в этом сообщении.
.
K: Нет, это не таблица композиционного генетического кода. Это архивный файл
1992 года, когда я начинал работать над расшифровкой таблицы. По этим данным
были определены первые 10% из 60 кодов.
.
Окончательная верстия таблицы находится по адресу:
http://ftp.decsy.ru/nanoworld/DATA/TEXTS.RUS/9990520.htm
Она была составлена в мае 1999 года. В разделе "Тексты" ее можно найти по
году 1999, месяцу 05 и дате 20. Номер текста состоит из года (первые четыре
цифры), месяца (две цифры) и числа (две цифры). Любой текст лекго найти, нажав
на верхней строке второе слово (Edit), в открывшемся окне "Find on this page",
а в окне поиска нужно набрать интересующее Вас слово или дату создания,
например, "9990520" или "таблица" или "генетическ" и т.д. В результате браузер
найдет Вам строчку, где содержится это слово. Чтобы попасть на самую свежую
версию интересующего Вас текста нужно прощелкать оглавление до самого конца
(самые свежие тексты написаны позже и расположены ниже).
.
Вставляю окончательную версию таблицы композиционного генетического кода:
.
Таблица код-остаток-вариант-частота-нота
.
N code code name subname var freq midi
.
00 AAA K Lys 3 746 66
01 AAC N Asn 1 995 71
02 AAG K Lys 1 746 66
03 AAT N Asn 3 995 71
04 ACA T Thr 2 1328 76
05 ACC T Thr 1 1328 76
06 ACG T Thr 4 1328 76
07 ACT T Thr 3 1328 76
08 AGA R Arg teta 3 591 62
09 AGC S Ser teta 1 1773 81
10 AGG R Arg teta 1 591 62
11 AGT S Ser teta 3 1773 81
12 ATA I Ile 2 1054 72
13 ATC I Ile 1 1054 72
14 ATG M Met 1 790 67
15 ATT I Ile 3 1054 72
16 CAA Q Gln 3 790 67
17 CAC H His 1 887 69
18 CAG Q Gln 1 790 67
19 CAT H His 3 887 69
20 CCA P Pro 2 3546 81
21 CCC P Pro 1 3546 81
22 CCG P Pro 4 3546 81
23 CCT P Pro 3 3546 81
24 CGA R Arg lambda 2 591 62
25 CGC R Arg lambda 1 591 62
26 CGG R Arg lambda 4 591 62
27 CGT R Arg lambda 3 591 62
28 CTA L Leu lambda 2 995 71
29 CTC L Leu lambda 1 995 71
30 CTG L Leu lambda 4 995 71
31 CTT L Leu lambda 3 995 71
32 GAA E Glu 3 790 67
33 GAC D Asp 1 995 71
34 GAG E Glu 1 790 67
35 GAT D Asp 3 995 71
36 GCA A Ala 2 3546 93
37 GCC A Ala 1 3546 93
38 GCG A Ala 4 3546 93
39 GCT A Ala 3 3546 93
40 GGA G Gly 2 395 55
41 GGC G Gly 1 395 55
42 GGG G Gly 4 395 55
43 GGT G Gly 3 395 55
44 GTA V Val 2 1579 79
45 GTC V Val 1 1579 79
46 GTG V Val 4 1579 79
47 GTT V Val 3 1579 79
48 TAA TKD 1 0 115
49 TAC Y Tyr 1 591 62
50 TAG TKD 1 0 115
51 TAT Y Tyr 3 591 62
52 TCA S Ser lambda 2 1773 81
53 TCC S Ser lambda 1 1773 81
54 TCG S Ser lambda 4 1773 81
55 TCT S Ser lambda 3 1773 81
56 TGA TKD 1 0 115
57 TGC C Cys 1 1328 76
58 TGG W Trp 1 591 62
59 TGT C Cys 3 1328 76
60 TTA L Leu teta 3 995 71
61 TTC F Phe 1 790 67
62 TTG L Leu teta 1 995 71
63 TTT F Phe 3 790 67
Вариант 1 соответствует вхождению остатка в 4/10 альфа-спираль. Одиночный
альфа-код соответствует вхождению в структуру, которая отличается от
альфа-спирали, бета-спирали, бета поворота, и представляет собой смешанную
последовательность.
Вариант 2 соответствует вхождения остатка в классический бета-слой.
Вариант 3 соответствует вхождению остатка в бета-поворот.
Вариант 4 соответствует вхождению остатка в 3/10 альфа-спираль.
.
.
.
20020113
П: Уважаемый Александр Юрьевич!
.
В Вашей таблице :
.
триптофан -TGG - (поз. 58) - это вар.1 и так как это единичный кодон, то это не
альфа-спираль, не бета-спираль (нитка?), не бета-поворот, так?
.
K: -Если в нуклеотидной последовательности до него и после него расположены
кодоны варианта 2 или 3, то это не альфа-спираль. Если же он входит в
последовательность 1-1-1-1(4/10 альфа-спираль) или 4-4-1-4 или 1-4-4
(3/10 альфа-спираль).
П: 58 TGG W Trp 1
K: Вообще, если бы Вы прочитали мою статью (вкладываю ее в письмо), то
сэкономили бы себе массу времени, т.к. все эти вопросы в статье рассмотрены.
П: В поз. - метеонин
14 ATG M Met 1
K: Рибосома ставит метионин всегда под одним и тем же углом "1". Химические
взаимодействия могли бы его изменить. Меняются даже структуры аминокислот после
сборки на рибосоме. Например, после сборки коллагена Pro модифицируется до
гидроксипролина, причем модификации подвергаются больше половины аминокислотных
остатков. Однако, в случае Met химическими взаимодействиями не меняется даже
угол, т.к. Met применяется фактически лишь для изгибания альфа-спирали методом
удлинения водородной связи между группой CO и группой NH четвертой по счету
пептидной группы. Метионин встречается и в смешанной последовательности, но
рибосома его ставит всегда под углом "1". Возможно, что в каких-то случаях его
нужно ставить под другим углом. Изменить угол можно либо подставив рядом
соответствующий радикал, который развернет Met на 120 градусов по или против
часовой стрелки (при этом вариант "1" сменится на "3" или на "2" соответственно),
либо после сборки должны поработать ферменты.
Именно ферменты разрезают проинсулин на два участка (с изгибами) альфа-спирали.
Эти участки соединяются между собой дисульфидными мостиками. Программа CASP.exe
показывает только ту структуру, которая сходит с рибосомы, причем, если
химические связи ее модифицируют, то это уже другая песня. Учет химических и
других взаимодействий помогает отследить некоторые из этих процессов, но уже с
использованием других программ и методов, часть из которых вообще не
запрограммированы. Сложные модели белков мы дорабатываем вручную.
.
П:
В поз -трианин
04 ACA T Thr 2
05 ACC T Thr 1
06 ACG T Thr 4
07 ACT T Thr 3
В поз. -тирозин
49 TAC Y Tyr 1
51 TAT Y Tyr 3
В поз. -изолицин 12 ATA I Ile 2
13 ATC I Ile 1
15 ATT I Ile 3
В поз. фенилаламин 61 TTC F Phe 1
63 TTT F Phe 3
В поз. аргенин 08 AGA R Arg bottom 3
10 AGG R Arg bottom 1
24 CGA R Arg top 2
25 CGC R Arg top 1
26 CGG R Arg top 4
27 CGT R Arg top 3
В поз. валин
44 GTA V Val 2
45 GTC V Val 1
46 GTG V Val 4
47 GTT V Val 3
В позх. лизин 00 AAA K Lys 3
01 AAC N Asn 1
Просьба к Вам - подтвердите, пожалуйста, что эта выборка из Вашей таблицы
соответствует Вашим последним результатам.
K: Треонин, тирозин, изолейцин, фенилаланин, валин и лизин показаны правильно.
Что касается аргинина, то буквально после отправления Вам вчерашнего письма я
обнаружил устаревшие данные. В настоящее время я склоняюсь к тому, что аргинин
имеет варианты изомеров, которые нужно назвать не top и bottom, а lambda и teta,
т.к. я возвращаюсь к моделям изомеров Arg 1992 года. Моя гипотеза о том, что
они могут быть другими и принципиально отличаться от ориентации радиклов других
аминокислот не подтвердилась.
.
Итак, для Arg я считаю правильной такой фрагмент таблицы:
08 AGA R Arg teta 3
10 AGG R Arg teta 1
24 CGA R Arg lambda 2
25 CGC R Arg lambda 1
26 CGG R Arg lambda 4
27 CGT R Arg lambda 3
Хотя, для Л.Б. Меклера изменение названий изомеров аргинина вряд ли имеет
какое-либо значение...
.
P/S
Посмотрите анимацию из раздела анимация с CD или с сайта. Она находится по
адресу: http://ftp.decsy.ru/nanoworld/DATA/AVI/PREVIEW/Bio.htm
Она поможет Вам понять о каких углах идет речь в таблице композиционного
генетического кода. Еще хорошо бы, чтобы Вы посмотрели научную статью.
Если Вы не можете попасть на нее по ссылке:
http://ftp.decsy.ru/nanoworld/DATA/PUBLIC/20000131/index.htm
то заходите на сайт http://ftp.decsy.ru/nanoworld/index.htm
входите в раздел "Texts", затем в раздел "Научные статьи", затем в статью:
"20000131 Построение масштабной модели структуры белка". В ней есть несколько
опечаток, но в целом она вполне отражает суть вопроса. Если что непонятно,
спрашивайте.
.
.
.
20020114 00.08 M: Здравствуйте Александр Юрьевич!
.
Наступило время для прямого контакта между Вами и мной. Я надеюсь, что Вы не
оспариваете верность присуждения Нобелевской премии Хансену Анфинсену за
доказательство того круциального эксперимента, согласно которому вся информация
для формирования трехмерной молекулы любого биологического полипептида
содержится в самой полипептидной цепи данного полипептида.
.
K: Я не против того, что Хансену Анфисену присудили Нобелевскую премию. Если он
всех убедил, что в аминокислотной последовательности содержится вся информация
для формирования трехмерной структуры, то почему бы ему не дать Нобелевскую
премию?
.
Но я не люблю доказательств. Помните, как говорил Менделеев? "Сказки
рассказывать всякий горазд, а ты поди, демонстрируй!".
Если существует определенный класс белковых молекул, которые способны
восстанавливать свою структуру полностью, если как угодно соединить в первичную
последовательность аминокислоты, то это не значит, что другие классы белков
поведут себя так же.
Так что любые обобщения хороши не более, чем гипотезы для дальнейшей проверки.
.
Мне же удалось открыть другой механизм, который позволяет по генетическому коду
сразу правильно ставить аминокислоты. Этот механизм сложился в процессе
эволюции и полностью согласован с механизмом укладки за счет физико-химических
взаимодействий.
.
Вы не задумывались, почему рибосома собирает белки быстро, а ренатурируют они
медленно? Это связано как раз с этим механизмом...
.
П: Верность этого наблюдения, а по существу закона Природы, подтверждается всем
опытом биологической химии и молекуляной биологии в целом.
.
K: Как видите, разница в скоростях сборки белков in vivo и in vitro уже давно
противоречило этому "закону Природы". Но, как у нас (на планете) любят иногда
толкать науку: "Если какой-то факт противоречит теории, тем хуже для него..."
.
Ваше утверждение о том, что третья буква кодона задает положение любого
аминокислотного остатка в цепи, по существу означает опровержение этого закона.
.
K: Я бы сказал, не опровержение, а уточнение. Алгебра композиционного
генетического кода не опровергает арифметики аминокислотной последовательности.
.
M: Почему? Потому что в полипептидной цепи, как таковой, не содержитеся никаких
сведений, какой кодон привел к появлению данного аминокислотного остака в данной
позиции полипептидной цепи.
.
K: Дело не в том, какой кодон, а дело в том, что каждый кодон может скомандовать
рибосоме правильно поставить очередной остаток во вторичную структуру белка.
Когда этого механизма не было (он появился в процессе эволюции), то белки
вынуждены были собираться по тому самому "закону Природы", за который получена
Нобелевская.
.
Кстати, этот самый "закон Природы" тоже появился не сразу. Был период эволюции,
когда белки могли образовываться лишь путем "самосборки". У некоторых вирусов
этот механизм сохранился до настоящего времени. Кстати, механизм самосборки ни
чуть не меньше заслуживает Нобелевской.
.
Так, что если за открытие композиционного генетического кода выдадут еще одну
Нобелевскую, не удивляйтесь. У природы законов для Нобелевской немерено...
.
M: Я попытался, исходя из сведений, которые сообщил мне Павел Леонович, выяснить
действительно ли Вы можете предсказывать положение аминокислотного остатка в
третичной структуре биополипептидов применительно к двум самым простейшим
случаям - аминокислотным остаткам, кодирумым лишь одним кодоном.
.
Как известно, таких аминокислотных остатков всего два - метионин и триптофан.
Судя по тому, что мне прочел Павел Леонович, вы утверждаете, что аминокислотный
остаток триптофана в трехмерных молекулах биополипептидов может находиться либо
в составе классической альфа -спирали, либо в безструктурной части молекулы.
.
А насколько я помню, в трехмерной молекуле лизоцима белка куриного яйца два
рядом стоящих аминокислотных остатка триптофана (64 и 65 ) входят в состав бета
-структуры этой трехмерной молекулы. Что Вы по этому поводу можете сказать?
.
K: Как я понял, со мной уже беседует не Павел Леонович Червонобродов, а Лазарь
Борисович Меклер?
.
Павел Леонович Вам прочел мое утверждение не полностью. Я по этому поводу
написал ему следующее:
"-Если в нуклеотидной последовательности до него и после него расположены
кодоны варианта 2 или 3, то это не альфа-спираль. Если же он входит в
последовательность 1-1-1-1(4/10 альфа-спираль) или 4-4-1-4 или 1-4-4
(3/10 альфа-спираль).
Вообще, если бы Вы прочитали мою статью (вкладываю ее в письмо), то сэкономили
бы себе массу времени, т.к. все эти вопросы в статье рассмотрены.
Рибосома ставит метионин всегда под одним и тем же углом "1". Химические
взаимодействия могли бы его изменить. Меняются даже структуры аминокислот после
сборки на рибосоме. Например, после сборки коллагена Pro модифицируется до
гидроксипролина, причем модификации подвергаются больше половины аминокислотных
остатков. Однако, в случае Met химическими взаимодействиями не меняется даже
угол, т.к. Met применяется фактически лишь для изгибания альфа-спирали методом
удлинения водородной связи между группой CO и группой NH четвертой по счету
пептидной группы. Метионин встречается и в смешанной последовательности, но
рибосома его ставит всегда под углом "1". Возможно, что в каких-то случаях его
нужно ставить под другим углом. Изменить угол можно либо подставив рядом
соответствующий радикал, который развернет Met на 120 градусов по или против
часовой стрелки (при этом вариант "1" сменится на "3" или на "2" соответственно),
либо после сборки должны поработать ферменты.
Именно ферменты разрезают проинсулин на два участка (с изгибами) альфа-спирали.
Эти участки соединяются между собой дисульфидными мостиками. Программа CASP.exe
показывает только ту структуру, которая сходит с рибосомы, причем, если
химические связи ее модифицируют, то это уже другая песня. Учет химических и
других взаимодействий помогает отследить некоторые из этих процессов, но уже с
использованием других программ и методов, часть из которых вообще не
запрограммированы. Сложные модели белков мы дорабатываем вручную."
.
Понятно, что если Met можно развернуть за счет химических взаимодействий, то
Trp тоже.
.
Что касается двух Trp в бета-структуре лизоцима куриного яйца, то во-первых
один из них Tyr64, во-вторых, как я только что объяснил, после выхода белка с
рибосомы его можно модифицировать разными способами (внешними, т.е. ферментами
и внутренними, т.е. внутримолекулярным взаимодействием). В-третьих бета-структура
лизоцима - всего лишь гипотеза исследователей, интерпретирующих РСА. Моя
программа показывает, что структура лизоцима является шедевром микроархитектуры,
отличным от альфа-спирали, бета-нити, омега петли и прочих моделей, которыми
(за неимением лучшего) вынуждены сегодня пользоваться исследователи.
.
M: Еще однозначнее ситуация с аминокислотным остатком метианина. Вы пишете:
.
>K: "Рибосома ставит метионин всегда под одним и тем же углом "1". Химические
взаимодействия могли бы его изменить. Меняются даже структуры аминокислот после
сборки на рибосоме. .........Однако, в случае Met химическими взаимо действиями
не меняется даже угол, т.к. Met применяется фактически лишь для изгибания
альфаспирали методом удлинения водородной связи между группой CO и группой NH
четвертой по счету пептидной группы. Метионин встречается и в смешанной
последовательности, но рибосома его ставит всегда под углом "1". Возможно, что
в каких-то случаях его нужно ставить под другим углом. Изменить угол можно либо
подставив рядом соответствующий радикал, который развернет Met на 120 градусов
по или против часовой стрелки (при этом вариант "1" сменится на "3" или на "2"
соответственно), либо после сборки должны поработать ферменты.
Именно ферменты разрезают проинсулин на два участка (с изгибами) альфа-
спирали. Эти участки соединяются между собой дисульфидными мостиками".(!!!? -Л.Б) .
.
Сообщаю, что фермент триптин отрезает проинсулиновую петлю (коннектин пептид)
уже после того как молекула инсулина сформирована со всеми ее тремя
дисульфиднвми связями, освобождая таким образом активный центр инсулина,
который блокировался коннектин пептидом.
.
K: Вы меня не правильно поняли. Я не писал, что участки соединяются после
разрезания. Я имел в виду, что они удерживаются именно дисульфидными мостиками.
Возможно, я неудачно выбрал слово.
.
M: Затем мономер инсулина образует димер - биологически не активный. Почему?
Потому что этот димер всегда находится в конформации кристалла ( твердая
молекула). Этот димер распадается на мономеры в точном соответствии с
разработанной мной теорией функционирования биологических полимеров при
концентрации меньше 10/ в минус десятой моля/, переходя при этом в возбужденную
(жидкую) форму, и именно поэтому возвращая себе биологическую активность.
.
Обратите внимание на тот несомненный факт, что инсулин морской свинки не
образует димеры и поэтому активен при любой концентрации. А димеры не образует
по простой причине. Об этой причине, если я не ошибаюсь, говорится в статье,
опубликованной нами в журнале "Природа",№5,1993. Изменение аминокислотного
состава в области димеризации, приводящее к тому факту, что (согласно
открытому мной П - К коду) подтверждается хотя бы результатами сравнения
спектров кругового дихроизма молекулы морской свинки, с одной стороны, и любых
инсулинов, образующих димеры, с другой.
.
Как видим, все эти изменения вторичных структр этих инсулинов происходят при
неизменной их первичной структуре, а следовательно, и структуре генов, которые
эти инсулины кодируют.
.
K: Если Вы имеете в виду изменение структуры одного инсулина, то очевидно, что
гены тут уже ни при чем. Если же Вы хотите сказать, что другой инсулин имеет
другую конформацию, но ту же первичную структуру, то кодирующий его ген может
быть другим. Кстати, это легко проверить...
.
M: Заметьте, вне всякой связи с третьей буквой кодонов, ибо мутационная замена
третьей буквы, не изменяющая смысла данного кодона, нисколько не влият на
последующие процессы формирования их трехмерных молекул.
.
K: Замена третьей буквы оказывается влияет на скорость процесса формирования
трехмерной структуры. Кроме того, есть обширный класс белков, которые после
мутации гена будут иметь другую третичную структуру. Вы разве не в курсе, что
одни и те же последовательности аминокислотных остатков могут образовать и
бета-нить и альфа-спираль? Если при этом это единственная нить или альфа-спираль,
то как Вы это объясните?
.
M: И, напротив, одни и те же аминокислотные остатки молекулы инсулина, которые
кодируются одним определенным кодоном из четырех могут тем не менее содержаться
и в бета-структуре и в бесструктурных областях в результате распада димера
инсулина на две молекулы мономеров инсулина.
Что Вы на все это скажете?
.
K: Хочу еще раз напомнить, что прочитав мою статью и полный текст писем Павлу
Леоновичу, Вы могли бы сэкономить массу своего времени, т.к. я уже писал выше,
что композиционный генетический код управляет только работой рибосомы. Что
будут делать ферменты или внутренние взаимодействия в белковой молекуле -
таблицу композиционного кода не касается. Распадется димер инсулина на две
молекулы или не распадется - решать физико-химическим взаимодействием.
Композиционный код лишь помогает белкам сразу обрести "причесанный вид", хотя в
отдельных случаях рибосома делает конформацию белка, которая потом
перестраивается, т.к. в некоторых случаях (их не так много) это выгодно из
конструктивных соображений. В процессе эволюции отбираются именно те коды,
выполнение которых максимально быстро и надежно выдает результат. При этом
неисповедимы пути конкретных алгоритмов. С каждым можно разбираться
индивидуально, но факт существования композиционного кода - это не игра с
десятком белков. Это достоверно выверенная по общепринятым критериям значимости
модель, которая работает бесспорно на большом классе белков, находящихся на
определенной стадии эволюции.
.
Не все белки собираются по таблице композиционного кода. Есть так называемые
консервативные белки, которые собираются "по старинке", а есть вообще белки,
которые собираются не рибосомой. Помните самосборку?
.
Так что, если хотите утверждать, что композиционного кода не существует,
ознакомьтесь сначала с демонстрацией его возможностей, а пока Ваши аргументы
говорят мне лишь о том, что Вы не знакомы с ним совершенно...
.
M: Довожу до Вашего сведения, что трехмерная структура инсулина формируется в
составе проинсулина. Я строил втемную модели трехмерных молекул проинсулинов
трех видов ( человека, свиньи и рыбы), и во всех случаях правильно - они
сходились с РСА ( Розалия Григорьевна может это подтвердить).
.
Л.Б.Меклер
.
K: Если Вы хотите меня убедить в том, что Ваш метод содержит полезные сведения,
то мне бы хотелось для начала посмотреть на вторичную структуру трех участков
разных белков, которые я выслал Вам по просьбе Павла Леоновича.
.
Если Ваша вторичная структура трех участков по 20 остатков совпадет со
структурой хорошо изученных белков, то можно будет поговорить и о третичной
структуре. Если же вторичная структура не сойдется, то придется сначала
разбираться именно со вторичной структурой. Согласитесь, что не может правильно
строиться третичная структура, если вместо альфа-спирали идет бета-нить или
наоборот. Или я не прав?
.
С уважением и надеждой на вторичные структуры трех участков разных типов
белковых структур.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020114 16.30
П: Уважаемый Александр Юрьевич!
.
Сообщаю, что я ознакомил Лазаря Борисовича с полным текстом Ваших комментариев
в письме №7, но его заинтересовал только вопрос о влиянии третьей буквы кодона
на положение любого аминокислотного остатка .
С Вашими ответами в 20020114 00.08 я также его познакомил. У него есть
категорические возражения.
Подожду, когда у него возникнет желание продолжить дискуссию, на мой взгляд,
весьма интересную.
Ваш Павел Червонобродов.
.
K: Я бы говорил не о влиянии третьей буквы, или влиянии не только третьей буквы.
Точнее было бы сказать о существовании функции триплет/ориентация. Влияние
третьей буквы - это как бы первое приближение более сложного процесса...
.
Что касается категорических возражений, то я больше всего люблю категорические
возражения и конструктивную критику. Именно блогодаря ей удалось отточить
множество моделей и тонких моментов в моей системе гипотез, в частности
связанных и с белками. Так что буду рад слышать критику, а вместе с ней надеюсь
увидеть что-нибудь полезное в методике Л.Б. Меклера, если у него действительно
получится угадать вторичные структуры трех типов. Но, даже если он их не
угадает, то что-нибудь полезное в его методике обязательно должно быть. Я лет 8
назад видел его плакат с названием похожим на "аминокислотный генетический код
или вторая половина генетического кода". Мне очень понравилось это название,
т.к. моя таблица копозиционного кода очень вписывается в название "вторая
половина", точнее "третья треть" генетического кода. Я с большим энтузиазмом
изучил его плакат, но до испытания методики мне тогда добраться не удалось,
т.к. не было понятно изложено, как же, по какому алгоритму строить структуру
белка в простых случаях, типа короткая альфа-спираль или изолированная бета-нить.
Я даже отсканировал его статью из журнала "Природа" и поместил в энциклопедию
Наномир. Недавно ее у меня попросила Роза Идлис. В этой статье очень красиво
показаны бумажные структуры разных белков, но прочитав ее я все-таки не смог
понять тех самых простых ситуаций, а я люблю начинать изучение чего-либо с
простых вещей. Если получается складывать, то начинаю учиться умножать. Если
2x2 умножаю правильно, то приступаю к более сложным вопросам. А тут как-то на
простом вопросе застопорился... Дай-ка думаю, напишу письмо Л.Б.Меклеру...
Поспрошал знакомых, а они и говорят: "Уехал заграницу... концов нет...". Просил
Розу Идлис связать с Лазарем Борисовичем, да она что-то не смогла... А тут
счастливый случай! Сам изобретатель "второй половины генетического кода". Уж
он-то должен построить простые структуры. Если у него не получится, то мне по
его методике лучше даже и не соваться... А если получится, то признание мировой
общественности я думаю будет гарантировано.
.
Дискуссия действительно получается очень интересная. Главное, чтобы все было
без обид. Если я что обидное напишу, знайте, что не специально. Л.Б. Меклера я
очень уважаю, поэтому специально обидеть не хочу, честное слово. А с другой
стороны, без аргументов верить просто не могу, т.к. в науке "верю-неверю" не
работает. Если сказал:"Могу построить", значит придется строить... В этом и
отличие науки от религии, согласитесь.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
20020114 17.05
.
.
.
20020115 08.44
П: Уважаемый Александр Юрьевич!
.
Из услышанных мной комментариев Лазаря Борисовича:
1. Он решительно несогласен с Вашим утверждением о неточности структур (их
около 10 тысяч), полученных способом РСА. Он утверждает, что разрешающая
способность РСА столь высока (половина ангстрема), что исключает
неопределенность. Он называет чепухой то, что Вы ставите под сомнение эти
структуры, отрицая тем самым работы тысяч коллективов, использующих многократно
проверенные точнейшие количественные методы анализа.
Он утверждает, что Вы не сможете доказать фактическими примерами
неоднозначность структур одих и тех же молекул, находящихся в банке.
.
K: 1. Разрешающая способность РСА не одинакова не только для разных белков, но
даже вдоль структуры одного белка. 0.5 ангстрема - это рекорд на кристаллах
типа монокристалла кремния. Если говорить о белковых кристаллах и кристаллах с
включением РНК и ДНК, то нет ни одной экспериментальной картинки (ни фото под
туннельным микроскопом, ни рентгенограммы), на которой можно было бы различить
отдельные атомы скажем сопряженной системы бензола, азотистых оснований,
радикалов Phe, Tyr, Trp и любых других аминокислот. Место расположения радикала
аминокислоты (как неделимое целое) можно достоверно определить, включив в него
радиоактивный атом тяжелого элемента таблицы Менделеева. Более того, отдельные
участки белковой молекулы, целые фосфатные группы и даже части альфа-спиралей
вообще не видно на рентгенограммах. На самых лучших фотографиях из под
туннельного микроскопа бензольные кольца видны как пирожки, уложенные на
противень. Не видно даже формы молекулы бензола! На рентгенограммах нельзя
увидеть порядок расположения атомов в сопряженной системе азотистых оснований.
Даже 25 атомов порфиринового кольца воспринимаются рентгеном как одно пятнышко
без тонкой структуры! Так что о точности в пол ангстрема можно говорить, только
рентгенологи, с которыми я общался лично согласились, что на рентгенограммах
невозможно установить, на каком аминокислотном остатке заканчивается
альфа-спираль, т.к. сама альфа-спираль видна как нить без тонкой структуры.
Все, что Вы видите в Протеин-банке - это не более, чем модели, построенные на
предположениях, что азотистые основания состоят и шести- и пятиугольников,
которых никто еще не видел, на предположении, что квадратный ген и вообще
порфириновое кольцо тоже сделано из пяти- и шестиугольников. Как в
действительности расположены 25 атомов в квадратной пластинке Вы не увидите ни
на одной фотографии с разрешением 0.5 ангстрема, хотя размер самой пластинки
(гема) составляет почти 10 ангстрем. Если Лазарь Борисович так доверился данным
из PDB, пусть он пообщается с конкретными людьми, которые проводят
рентгеноструктурный анализ и попросит показать ему экспериментальное
изображение, относящееся к порфириновому кольцу, бензолу, аденину, триптофану...
Пусть он лично убедится, что экспериментальных картинок с внутренней структурой
этих объектов не существует сегодня. Я тоже могу встать в позу и заявить, что
мои модели имеют рекордную точность 0.1 пикометра, но только для регулярных
электронных структур типа кристалла алмаза. Для белков эта точность в 100 раз
хуже, но при этом в 1000 раз лучше точности рентгеновских и туннельных данных.
Я же этого не делаю. Я просто беру генетический код белка, который мне
предлагает, например профессор В.Г. Туманян из института молекулярной биологии,
который десятками лет исследует структуры белков. Запускаю свою программу,
ввожу нуклеотидную последовательность конкретного белка (гормона
панкреатической железы свиньи). Владимир Гаевич смотрит на форму модели,
которую строит моя программа или PDB-вьюер по данным CASP.exe и с удивлением
говорит: "А как же Вы ее получили? Я-то знаю, что она такая, но ведь
рентгеновских данных по этому белку не существует?!" После этого он утверждает,
что моя программа работоспособна, хотя как она работает он тогда еще не знал.
.
Я тоже не знаю, какие медоты у Лазаря Борисовича, но если я увижу результат
работы его методов (модели трех участков белковых молекул, в структуре которых
у меня сомнений нет), то я скажу: "Дорогой Лазарь Борисович ! Я пока не знаю,
как Вы это делаете, но это - гениально!". На месте Л.Б. Меклера я бы не стал
доказывать, что какой-то незнакомый мне метод - полная чушь, не убедившись в
том, что этот метод не работает. Я же готов запустить свою программу с
нуклеотидной последовательностью любого белка, который Вы захотите сравнить.
Мне это не трудно. Если белок строится правильно, то сами понимаете, что смешно
звучит высказывание о том, что "...чепуха то, что Вы ставите под сомнение
эти структуры, отрицая тем самым работы тысяч коллективов, использующих
многократно проверенные точнейшие количественные методы анализа."
Вы же понимаете, что эти "тысячи коллективов" используя "многократно
проверенные точнейшие количественные методы анализа" каждый год уточняют данные
в Протеин-банке. Если данные правильные, то зачем же их уточнять?
.
Что касается фразы:"Вы не сможете доказать фактическими примерами
неоднозначность структур одих и тех же молекул, находящихся в банке", то как
Л.Б. относится к "невидимым" фрагментам или так называемым "хвостам" белковых
молекул? Это что, однозначность, если десяток аминокислот и все фосфатные
группы просто не видны?
Я приведу конкретный пример. Возьмем первый попавшийся файл из PDB. Я вкладываю
в письмо шапку этого файла (undef.txt). Посмотрим, что в нем написано.
REMARK 3 RESOLUTION RANGE HIGH (ANGSTROMS) : 1.50
REMARK 3 RESOLUTION RANGE LOW (ANGSTROMS) : 8.00
.
Я думаю, что Л.Б. не будет комментировать эти данные как однозначность
структуры данных РСА? Разрешение 8 ангстрем - это как раз целое порфириновое
кольцо, в котором не видно ни одного атома.
.
Опускаемся ниже по тексту файла из Протеин-банка:
REMARK 200 RESOLUTION RANGE HIGH (A) : 1.5
REMARK 200 RESOLUTION RANGE LOW (A) : 19.9
.
Вы замечаете, какой разброс точности вдоль структуры белка? Некоторые участки
белка (RANGE = 19 ангсерем) представляют собой практически белые пятна. Если их
прокоменнтировать не как однозначность, то как? Пусть Л.Б. прокомментирует их
как-нибудь иначе, если сможет... Это же те самые данные, с которыми по его
словам у него полное совпадение! Для меня это звучит приблизительно так: Вась!
-Чаво? -Ты что делаешь? -Ничаво! -А Петька чаво? -А Петька мне помогает...
Я бы не стал гордиться, если бы мои данные совпали с отсутствием данных "тысяч
коллективов", которые "точнейшими методами" это "ничаво" измерили.
.
П: 2. Если взять для примера ген, который содержит букву "U" на конце, то это
означает по Вашему, что валин может быть только в составе бета-структур.
Но это неверно хотя бы в отношении инсулина, (валин находится в той части
молекулы инсулина, которая, связываясь друг с другом, образует димер) потому
что, если разбавить раствор в два раза, то валин может быть в составе димера
в такой же степени, как и в составе мономера, а по Вашему этого не может быть
- димер не должен распадаться, если даже разбавить раствор 500 раз.
.
K: Давайте рассмотрим структуру инсулина. Оригинал таблицы (с красивым
расположением символов) вкладываю в письмо (ocinsaa.txt)
.
В первом стоблце - нуклеотидная последовательность инсулина из EMBL.
Во втором столбце - аминокислотная последовательность проинсулина, полученная
по таблице генетического кода.
3 - аминокислотная последовательность из Протеин-банка.
4 - последовательность вариантов композиции (углов) по таблице композиционного кода.
5 - номера аминокислотных остатков инсулине из Протеин-банка.
6 - нуклеотидная последовательность из EMBL инсулина из другого организма.
7 - аминокислотная последовательность по таблице генетического кода
8 - аминокислотная последовательность из Протеин-банка.
9 - последовательность вариантов композиции (углов) по таблице композиционного кода.
.
Композиционные углы Cys, His, Gln поставлены по старой таблице не правильно.
По новой таблице они попадают в альфа-спираль. Я не стал исправлять, чтобы
было видно, как по надежным данным РСА корректировалась таблица композиционного
генетического кода.
.
OCINSAA.OUT PDB9INS.ENT INS_OLD.OUT PDB9INS.ENT
* * * *
1 TTT Phe PHE 3
2 GTC Val VAL 1
3 AAA Lys ASN 3
4 CAG Gln GLN 1
CGC Arg 1 5 CAC His HIS 2
GAG Glu 1 6 CTT Leu LEU 3
GTG Val 4 7 TGT Cys CYS 1
GAG Glu 1 8 GGT Gly GLY 3
GAG Glu 1 9 CCT Pro SER 3
CTG Leu 4 10 CAC His HIS 2
CAG Gln 1 11 CTG Leu LEU 4
GTG Val 4 & 12 GTG Val VAL 4
GGG Gly 4 13 GAG Glu GLU 1
CAG Gln 1 14 GCT Ala ALA 3
GCG Ala 4 15 CTG Leu LEU 4
GAG Glu 1 16 TAC Tyr TYR 1
CTG Leu 4 & 17 CTG Leu LEU 4
GGC Gly 1 18 GTG Val VAL 4
GGG Gly 4 19 TGT Cys CYS 1
GGC Gly 1 & 20 GGG Gly GLY 4
CCC Pro 1 21 GAA Glu GLU 3
GGC Gly 1 22 CGT Arg ARG 3
GCG Ala 4 23 GGT Gly GLY 3
GGC Gly 1 && 24 TTC Phe PHE 1
GGC Gly 1 && 25 TTC Phe PHE 1
CTG Leu 4 26 TAC Tyr TYR 1
CAG Gln 1 27 ACA Thr THR 2
CCC Pro 1 & 28 CCC Pro PRO 1
TCG Ser 4 29 AAG Lys LYS 1
GCG Ala 4 & 30 TCC Ser ALA 1 *
CTT Leu 3 *
TAT Tyr 3 * ЭТОТ
CTG Leu 4 * КУСОК
GCC Ala 1 * НУЖНО
CTG Leu 4 * ОТКУСИТЬ
CAG Gln 1 * ?????
AAG Lys 1 *
CGC Arg 1 *
1 GGC Gly GLY 1 1 GGC Gly 1
2 ATC Ile ILE 1 ? 2 ATT Ile 3
3 GTG Val VAL 4 3 GTG Val 4
4 GAG Glu GLU 1 ?* 4 GAT Asp 3
5 CAG Gln GLN 1 5 CAG Gln 1
6 TGT Cys CYS 1 ? 6 TGC Cys 2
7 TGC Cys CYS 2 7 TGC Cys 2
8 ACC Thr THR 1 8 ACC Thr 1
9 AGC Ser SER 1 9 AGC Ser 1
10 ATC Ile ILE 1 10 ATC Ile 1
11 TGC Cys CYS 2 11 TGC Cys 2
12 TCG Ser SER 4 12 TCC Ser 1
13 CTC Leu LEU 1 13 CTC Leu 1
14 TAC Tyr TYR 1 14 TAC Tyr 1
15 CAG Gln GLN 1 ? 15 CAA Gln 3
16 CTG Leu LEU 4 16 CTG Leu 4
17 GAG Glu GLU 1 17 GAG Glu 1
18 AAC Asn ASN 1 18 AAC Asn 1
19 TAC Tyr TYR 1 19 TAC Tyr 1
20 TGC Cys CYS 2 20 TGC Cys 2
21 AAC Asn ASN 1 21 AAC Asn 1
22 TAG TKD 1
.
Там, где написано "Этот кусок нужно откусить" данных РСА у меня не было. Именно
на этом участке моя программа показала поворот альфа-спирали на 180 градусов
(последовательность вариантов 4-4-3-3-4).
.
Все Val, которые встречаются в структуре инсулина ставятся рибосомой по коду
CTG в 3/10 альфа-спираль. Где Л.Б. нашел код бета-нити я не вижу. Пусть уточнит
номер остатка инсулина и кодирующий его триплет.
.
П: 3, Касаясь Вашего предложения о построении Л.Б.Меклером "простых структур",
он решительно отвергает правомерность такого подхода, подчеркивая уже ранее
высказанную мысль, что строит трехмерные структуры (они форма жизни) и только в
составе их можно сравнивать отдельные участки "вторичных структур трех типов".
.
K: Я же прислал полные последовательности белков! Если Лазарю Борисовичу угодно,
он может построить эти белки целиком, а я в них посмотрю (с его разрешения)
только интересующие меня фрагменты. Я надеюсь, что в его трехмерной структуре
будет содежраться информация о вторичной структуре этих белков. Согласитесь,
что нельзя создать предложение без слов, а слова без букв...
.
П: Мне хотелось бы, как и Вам, чтобы дискуссия продолжилась для выяснени
истины. И тогда, согласен с Вами, "признание мировой общественности ... будет
гарантировано".
.
Ваш Павел Червонобродов.
.
K: Я рад, что Вы меня поддерживаете в моем желании добраться до истины.
Согласитесь, что сделать обиженное лицо, сказать, что у меня все правильно, а у
остальных - чепуха - это ненаучный подход. Если взялся сделать модель белка, то
нужно сделать, иначе мировая общественность не поймет...
.
С уважением и надеждой увидеть меклеровские модели трех белков (если необходимо,
то целиком).
Ваш Кушелев.
nanoworld@bigfoot.com
.
.
.
20020115 20.30
П: Уважаемый Александр Юрьевич!
.
В ожидании дальнейшего участия Л.Б.Меклера в обсуждении профессиональных
вопросов, хотел бы поговорить о возможном влиянии не биологов (я один из них)
на проблему практического использования открытия механизма превращения в живом
организме линейной аминокислотной цепочки в ту или иную белковую молекулу,
выполняющую предназначенную ей функцию, речь о фолдинге и о компьютерной
программе, реализующей алгоритм фолдинга.
.
Л.Б.Меклер уверен, что овладел тайной фолдинга и соответствующего алгоритма.
Я и другие, поддерживающие его непрерывную деятельность на этом поприще, слышим
от него, что умея строить модель возбужденой белковой молекулы (согласно коду
А - А ), он может проектировать пептиды, прицельно, без вредных побочных
последствий, способные излечить СПИД, злокачественные опухоли и другие ныне
неизличимые болезни.
.
Причину, по которой он не открывает научному миру свое ноу-хау, он объясняет
опасением, что оно будет использовано в первую очередь во вред человечеству,
например, для создания психотропных средств, в частности, способных превращать
человека в зомби.
.
Привлечение внимания к обсуждаемой проблеме тех тридцати тысяч посетителей в
год Вашего сайта "Наномир" может открыть уникальную возможность создания
общественного мнения, способного выступить гарантом применения открытия
фолдинга во благо человечеству.
.
Тогда Меклер сможет снять завесу секретности с алгоритма фолдинга. А пока я
говорю об этом для того, чтобы ход выяснения истины (есть ли решение проблемы
фолдинга Меклером или Кушелевым или ими вместе по принципу взаимодополнения)
проходило бы на языке, доступном для понимания широчайшего круга посетителей
Вашего сайта в Интернете.
.
K: А какие проблемы? Подключайтесь! На сайте Наномир существует клуб Наномир.
Любой желающий может стать его участником. Для этого достаточно прислать набор
файлов, один из которых должен называться index.htm. Если информация, которую
Вы пришлете не противоречит законодательству, то я ее выставлю под Вашей
фамилией в клубе Наномир.
.
Наша переписка уже вошла в состав второго CD NanoWorld2002 и скоро будет видна
через Internet.
.
Если существует компьютерная программа, реализующая алгоритм Меклера, то ее
тоже можно разместить под его фамилией в клубе Наномир. Эта программа может
работать по секретному алгоритму. Если исходный текст программы не публиковать,
то она так секретной и останется.
.
Что касается влияния не биологов на процесс внедрения программ по биологии, в
частности фолдинга, то я это представляю так:
Есть предмет разговора - программа или что-то другое, давайте обсудим. Если оно
работоспособно, я за то, чтобы внедрять. Существуют стандартные способы
внедрения.
1. Есть хороший товар, нет начального капитала (мой случай).
Выставляем в Internet и ждем желающих бесплатно попробовать и, если понравится,
то приобрести один из вариантов (в моем случае программы).
Как этот способ работает можно посмотреть в разделе "Переписка". Несколько
десятков биологов из разных стран после рассылки по электронной почте целевой
рекламы попросили построить интересующие их белки. С некоторыми из них
произошел обмен несколькими письмами. Из США один биолог заехал в лабораторию
Наномир (можно посмотреть видеозапись). В конце беседы он высказал следующее:
"Ну, мы у Вас через Internet все, что можно скачаем, попробуем применить в
своей работе (неофициально), а официально мы не можем купить у Вас программу,
т.к. это означает взять на себя ответственность за результат ее использования.
Другое дело РСА. Ошибается он на пять аминокислот или нет, видит он бета-нити
или альфа-спирали, нас по существу это не сильно волнует. Важно, что он
утвержден NCBI, а следовательно, если что не так, то с нас не спросят. Если же
мы воспользуемся Вашей программой, выдадим рекомендацию или создадим продукт,
а из-за ошибки в Вашей программе кто-нибудь погибнет, а отвечать придется нам,
т.к. Ваша программа не утверждена NCBI. Когда у Вас будет соответствующий
документ, то нет проблем, звоните, пишите, с удовольствием купим и
воспользуемся.
После этого мы решили по-участвовать в конкурсе CASP, но как Вы уже знаете, нас
там убрали из числа участников после того, как мы передали все файлы
предсказывающие структуры белка, которые еще только планировалось изучить
методом РСА.
Я не утверждаю, что это сделано со злым умыслом, но очевидно, что
интересующиеся новыми методами биологи не могут посмотреть наши данные на сайте
CASP. Согласитесь, что это в определенном смысле тормозит ознакомление с нашим
методом специалистов, которые не смогут найти интересующую их информацию на
слаборазрекламированном сервере decsy.ru
Резюмируя можно сказать, что даже хороший товар без начального капитала может
долго ждать своего покупателя, который просто не знает о его существовании.
.
2. Есть товар, есть начальный капитал.
Проводится рекламная кампания, и товар начинает продаваться. Есть справки или
нет, для хорошего товара большого значения не имеет, т.к. он не вызовет
нареканий.
.
3. Есть начальный капитал, но товар неудачный.
Деньги пойдут по ветру.
.
Резюме. Если у Вас или других не биологов, которых Вы можете привлечь к этой
проблеме есть начальный капитал, то нужно начинать с независимой экспертизы.
Если товар (в данном случае программа CASP.exe или программа Меклера (если она
есть) или что-то ее заменяющее) обладает полезными свойствами, за которые
потребители заплатят деньги, то можно вкладывать в рекламную кампанию. При этом
не нужно забывать и о барьерах типа Минздрава и пр. Даже если товар опасный,
т.е. с помощью программы можно сделать не только лекарство, но и оружие, то
можно ведь писать на упаковке: Минздрав предупреждает: программа CASP.exe может
использоваться не только для борьбы с болезнями, но и для создания
биологического оружия. В частные руки не продавать!
.
Если Вам интересно создать общественное мнение, то я не думаю, что имеет смысл
проблему фолдинга выделять из общих проблем биологии. Какой смысл вводить
многоборье типа: зачем нам
1.Клонирование.
2.Расшифровка генома.
3.Решение проблемы фолдинга.
4.Бессмертие.
5.Дарвинизм.
6.Всякие вредные науки...
.
Я думаю, что чем меньше базара с далекими от науки людьми на научные темы, тем
быстрее развивается наука.
.
Если хотите ознакомить общественность с проблемой фолдинга, то нет проблем.
Ставьте материал в клуб Наномир, публикуйте в газетах, рассказывайте по TV, а
что касается обсуждения научной проблемы с 30 000 не биологов, то меня это не
привлекает. Как это может повлиять на внедрение программы? Я думаю, что
типичное влияние можно наблюдать на примере клонирования. Церковь и разные
государства запрещают научные исследования в этом направлении, а отдельные
личности с приличным капиталом предлагают заняться этими исследованиями на
орбите, где законы земных государств бессильны.
Таким образом, чем позже начнется базар о вреде фолдинга, генома, клонирования
и др. вредных наук, тем меньше денег понадобиться для проведения научных
исследований. (Орбитальная станция не дешево стоит).
.
Что касается гарантий для Л.Б.Меклера, то они пригодятся ему лишь в том случае,
если его секретное Ноу-Хау работоспособно. Если я увижу результат его методики
на примере трех белков, то будем добиваться гарантий для Л.Б. Меклера, а если
не увижу, то предпринимать что-то не зная ради чего - не мой стиль.
.
С уважением,
Ваш А.Кушелев
nanoworld@bigfoot.com
.
.
.
20020116 утро
M: Аминокислотные последовательности А -цепи и В-цепи инсулина человека и
соответствующие им триплеты, которыми Вы пользуетесь
.
K: Я присылал Вам нуклеотидную последовательность инсулина кролика (как
выяснилось). С ней сравнивалась короткая аминокислотная последовательность из
того же организма, т.е. кролика (нижний синий столбец см. вложенный рисунок),
который символизирует альфа-спираль по рентгену.
.
 .
Вторичная структура в формате htm
.
Верхний синий столбец - большая альфа-спираль инсулина из другого организма
(гомологичная). Верхний синий столбец также символизирует альфа-спираль по
рентгену.
.
Красный столбец - вторичная структура инсулина кролика по программе CASP.exe
.
Если Лазаря Борисовича интересует нуклеотидная и аминокислотная
последовательность инсулина человека, то он ее может взять из EMBL или другого
банка нуклеотидных последовательностей.
.
Если Л.Б. хочет увидеть результат работы программы CASP.exe на примере
нуклеотидной последовательности инсулина человека, то он может либо сам
запустить программу CASP.exe, открыть в ней файл с нуклеотидной
последовательностью инсулина человека и увидеть результат (вторичная структура
будет выглядеть приблизительно так, как на вложенном рисунке, третичная - в
виде файла в стандарте PDB), либо присылайте мне любую нуклеотидную
последовательность в любом формате (в частности можете прислать
последовательность инсулина человека), а я сам запущу программу CASP.exe, а
результаты ее работы перешлю Вам.
.
См. вложенный рисунок и вложенный файл dne с нуклеотидной последовательностью
инсулина кролика.
.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020116 вечер
П: Ниже текст, продиктванный по телефону Л.Б.Меклером.
.
M: Здравствуйте Александр Юрьевич!
.
Я живу в помещении, где есть только телефон - мой единственный выход в мир.
Все остальное у Павла Леоновича.Он специалист по автомобилям и для него
выполнение этой работы титанический труд.
.
K: Я, к сожалению, тоже живу и работаю в чужом помещении, где есть только
телефон. Поэтому весь мир для меня виден через мерцающую дырочку модемного
канала, который в России работает не каждый час... Моя мечта - выделенная линия,
но провести ее в чужое помещение нет возможности. Остается только надеяться на
спутниковый Internet, но пока не по карману...
.
M: Поэтому, если Вы хотите, чтобы я получил возможность поработать над Вашим
материалом, я должен получать его в том виде, в котором я могу с ним работать.
А именно: необходимо колиниарная запись нуклеотидной последовательности бета -
цепи инсулина любого вида животного и колиниарная запись альфа-цепи.
.
K: В инсулине по данным РСА и по программе CASP.exe есть только две субъединицы,
которые представляют собой участки альфа-спирали. Бета-нитей в инсулине не
обнаружено...
.
Коллинеарная запись нуклеотидной последовательности инсулина кролика,
содержится в файле ocinsaa.dne. На картинке, которую я прислал в прошлом письме
эта последовательность расположена в третьем столбце, который называется
DNA-Seq.
.
Если Вы не смогли ее прочесть в файле ocinsaa.dne и в третьем столбце на
иллюстрации, то могу ее вставить в текст письма:
cgcgaggtgg aggagctgca ggtggggcag gcggagctgg gcgggggccc cggcgcgggc ggcctgcagc
cctcggcgct ttatctggcc ctgcagaagc gcggcatcgt ggagcagtgt tgcaccagca tctgctcgct
ctaccagctg gagaactact gcaactaggg gtgcccccca cccacccctg cccgcgcccc ccacgccccc
cgccctcgcc cccacccaat aaacccctcc acgcgccccc
.
M: Желательно иметь полную запись гена этого животного, начиная с пре-конца,
включая коннектин пептид. Это первое.
.
K: Я Вам могу послать только эту последовательность из нуклеотидного банка EMBL.
Прибавить к ней что-либо не в моей власти. Да и зачем Вам последовательность
инсулина более длинная, чем код проинсулина? Я же Вас не прошу строить модель
инсулина?! Вы и так знаете его структуру. Вы же хотели сравнить мою модель,
заложенную в программе CASP.exe с моделью из Протеин-банка. Я Вам послал
картинку, на которой красным цветом показана структура по программе CASP.exe,
а синим цветом показана структура инсулина из Протеин-банка. Обе модели
показывают два участка альфа-спирали, разделенные поворотом (две косых
голубеньких полосочки, разделяющие красные участки альфа-спирали). Этот самый
поворот цепи удаляется ферментами. В результате из проинсулина получается
инсулин. Если Вы эту картинку не можете увидеть, то Павел Леонович, наверное,
может Вам ее прислать по обычной бумажной почте, если Вы сами не выходите в
Internet.
.
M: Второе - в виде таблицы - указание, какой вторичной структуре соответствует
А(аденин), С(цитазин), G (гуанин), U( урацил).
.
K: Из этой фразы я вывожу, что мою таблицу композиционного кода Вы еще не
видели. Конечно, можно по телефону рассказывать, как выглядит таблица
композиционного генетического кода, но это будет трудно и долго.
.
Тем более не могу понять, а как же Вы в письме N8 от 13.01.2002 писали мне
вопросы и вставляли фрагменты моей таблицы:
04 ACA T Thr 2
05 ACC T Thr 1
06 ACG T Thr 4
07 ACT T Thr 3
У меня сложилось впечатление, что Вы ее видели или по крайней мере поняли, что
по коду ACC треонин ставится по варианту 1. Если этот вариант 1 повторяется
больше 4 раз, то образуется альфа-спираль.
.
Теперь, в десятом письме Вы пишите: "какой вторичной структуре соответсвует
аденин и др.". Вы еще разок в таблицу-то загляните. Там соответствие "триплет -
вариант", а не "аденин-вариант". Каждому из 64 триплетов соответсвует либо
вариант композиции (1,2,3,4), либо остановка трансляции.
.
Если мы с Вами будем по несколько раз об одном и том же писать, то в этом
тысячелетии можем не успеть разобраться...
.
На всякий случай напомню еще раз, что меня в данный момент интересуют Ваши три
модели белков, обозначенных мною 1,2,3.
.
Повторяю полные аминокислотные последовательности этих трех белков (из ответа
на Ваше письмо N3):
.
Аминокислотная последовательность белка N1:
.
MET-LEU-THR-VAL-GLU-ILE-HIS-ASP-SER-GLN-VAL-SER-VAL-LYS-GLU-ARG-SER-GLY-VAL-SER-
GLN-LYS-SER-GLY-LYS-PRO-TYR-THR-ILE-ARG-GLU-GLN-GLU-ALA-TYR-ILE-ASP-LEU-GLY-GLY-
VAL-TYR-PRO-ALA-LEU-PHE-ASN-PHE-ASN-LEU-GLU-ASP-GLY-GLN-GLN-PRO-TYR-PRO-ALA-GLY-
LYS-TYR-ARG-LEU-HIS-PRO-ALA-SER-PHE-LYS-ILE-ASN-ASN-PHE-GLY-GLN-VAL-ALA-VAL-GLY-
ARG-VAL-LEU-LEU-GLU-SER-VAL-LYS
.
Аминокислотная последовательность белка N2:
.
MET-LYS-VAL-PHE-GLU-ARG-CYS-GLU-LEU-ALA-ARG-THR-LEU-LYS-ARG-LEU-GLY-MET-ASP-GLY-
TYR-ARG-GLY-ILE-SER-LEU-ALA-ASN-TRP-MET-CYS-LEU-ALA-LYS-TRP-GLU-SER-GLY-TYR-ASN-
THR-ARG-ALA-THR-ASN-TYR-ASN-ALA-GLY-ASP-ARG-SER-THR-ASP-TYR-GLY-ILE-PHE-GLN-ILE-
ASN-SER-ARG-TYR-TRP-CYS-ASN-ASP-GLY-LYS-THR-PRO-GLY-ALA-VAL-ASN-ALA-CYS-HIS-LEU-
SER-CYS-SER-ALA-LEU-LEU-GLN-ASP-ASN-ILE-ALA-ASP-ALA-VAL-ALA-CYS-ALA-LYS-ARG-VAL-
VAL-ARG-ASP-PRO-GLN-GLY-ILE-ARG-ALA-TRP-VAL-ALA-TRP-ARG-ASN-ARG-CYS-GLN-ASN-ARG-
ASP-VAL-ARG-GLN-TYR-VAL-GLN-GLY-CYS-GLY-VAL
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-LEU-
SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-PRO-SER-
CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-ALA-GLN-THR-
VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-ALA-VAL-ALA-PRO-
GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-HIS-ALA-ARG-TYR-LEU-
ALA-ARG-CYS-LEU
.
Вы можете сделать модели этих белков целиком, но меня в белке
N1 интересует участок с номерами аминокислотных остатков: 1...21
N2 интересует участок с номерами аминокислотных остатков: 96...117
N3 интересует участок с номерами аминокислотных остатков: 80...100
.
Еще меня интересует за какое время Вы можете сделать модель одного из этих
белков?
.
Дело в том, что у меня есть много интересных дел, от которых отрывать время мне
не хотелось бы. Другое дело, если бы Вы прислали мне модель хотя бы одного из
этих трех белков. Тогда у меня появился бы интерес и стимул. Не жалко было бы
потраченного времени. Поймите меня правильно, не могу же я тратить десятки
часов на то, чтобы, наконец понять, что Вы либо не видели мою таблицу
композиционного генетического кода, либо видели, но забыли...
.
Если Вы увидите картинку, которую я Вам послал с моей моделью (красного цвета)
и моделью из Протеин-банка (синего цвета), то Вы поймете, что они совпадают (с
точностью до ошибок интерпретации рентгена).
.
Если Вы захотите проверить лично, а не поверить мне на слово, то Вам придется
самому доставать нуклеотидную последовательность, запускать программу CASP.exe
и сравнивать полученные результаты с данными из Протеин-банка. Если Вы не
можете сами, то остается только верить... Тратить время на неэффективную беседу
типа "испорченный телефон" у меня нет возможности.
.
M: Если код, открытый Вами, поливариантин (по словам П.Л.) подтвердите
соответствие между буквами и соответствующими им вторичными структурами.
Буква А (аденин) -кодирует бета -нить. вар. 1,2,3. Буква С (цитозин),
кодирует альфа спираль (4/10) или бесструктурную область, вар.1. Буква G
(гуанит) кодирует по Вашему спираль 3/10 или альфа-спираль, вар.1,4. Буква Т
(тимин) кодирует бета изгиб. вар.1,3.
Подтвердите, пожалуйста, правильность интерпритации Павлом Леоновичем открытого
Вами кода и разработанной Вами теории. Если нет, введите,пожалйста,
соответствующие исправления.
Примите, пожалуйста, во внимание, что я располагаю только собственной памятью и
телефоном.
.
K: Повторю на всякий случай еще раз. Нет соответствия между отдельными буквами
и вариантом композиции аминокислот. Есть соответствие "Триплет-вариант".
.
Я думаю, что проще всего в Вашем случае, чтобы Павел Леонович распечатал на
принтере таблицу композиционного генетического кода, которую я еще раз привожу
в тексте письма:
.
Таблица код-остаток-вариант-частота-нота
.
N code code name subname var freq midi
.
00 AAA K Lys 3 746 66
01 AAC N Asn 1 995 71
02 AAG K Lys 1 746 66
03 AAT N Asn 3 995 71
04 ACA T Thr 2 1328 76
05 ACC T Thr 1 1328 76
06 ACG T Thr 4 1328 76
07 ACT T Thr 3 1328 76
08 AGA R Arg teta 3 591 62
09 AGC S Ser teta 1 1773 81
10 AGG R Arg teta 1 591 62
11 AGT S Ser teta 3 1773 81
12 ATA I Ile 2 1054 72
13 ATC I Ile 1 1054 72
14 ATG M Met 1 790 67
15 ATT I Ile 3 1054 72
16 CAA Q Gln 3 790 67
17 CAC H His 1 887 69
18 CAG Q Gln 1 790 67
19 CAT H His 3 887 69
20 CCA P Pro 2 3546 81
21 CCC P Pro 1 3546 81
22 CCG P Pro 4 3546 81
23 CCT P Pro 3 3546 81
24 CGA R Arg lambda 2 591 62
25 CGC R Arg lambda 1 591 62
26 CGG R Arg lambda 4 591 62
27 CGT R Arg lambda 3 591 62
28 CTA L Leu lambda 2 995 71
29 CTC L Leu lambda 1 995 71
30 CTG L Leu lambda 4 995 71
31 CTT L Leu lambda 3 995 71
32 GAA E Glu 3 790 67
33 GAC D Asp 1 995 71
34 GAG E Glu 1 790 67
35 GAT D Asp 3 995 71
36 GCA A Ala 2 3546 93
37 GCC A Ala 1 3546 93
38 GCG A Ala 4 3546 93
39 GCT A Ala 3 3546 93
40 GGA G Gly 2 395 55
41 GGC G Gly 1 395 55
42 GGG G Gly 4 395 55
43 GGT G Gly 3 395 55
44 GTA V Val 2 1579 79
45 GTC V Val 1 1579 79
46 GTG V Val 4 1579 79
47 GTT V Val 3 1579 79
48 TAA TKD 1 0 115
49 TAC Y Tyr 1 591 62
50 TAG TKD 1 0 115
51 TAT Y Tyr 3 591 62
52 TCA S Ser lambda 2 1773 81
53 TCC S Ser lambda 1 1773 81
54 TCG S Ser lambda 4 1773 81
55 TCT S Ser lambda 3 1773 81
56 TGA TKD 1 0 115
57 TGC C Cys 1 1328 76
58 TGG W Trp 1 591 62
59 TGT C Cys 3 1328 76
60 TTA L Leu teta 3 995 71
61 TTC F Phe 1 790 67
62 TTG L Leu teta 1 995 71
63 TTT F Phe 3 790 67
Вариант 1 соответствует вхождению остатка в 4/10 альфа-спираль. Одиночный
альфа-код соответствует вхождению в структуру, которая отличается от
альфа-спирали, бета-спирали, бета поворота, и представляет собой смешанную
последовательность.
Вариант 2 соответствует вхождения остатка в классический бета-слой.
Вариант 3 соответствует вхождению остатка в бета-поворот.
Вариант 4 соответствует вхождению остатка в 3/10 альфа-спираль.
.
Пусть эта таблица, распечатанная на бумаге, будет лежать у Вас перед глазами.
Я думаю, что глядя на нее у Вас не будут возникать вопросы, которые появляются
после передачи этой таблицы по телефону.
.
С Уважением и надеждой увидеть долгожданные модели трех белков (или хотя бы
одного). Вы уж назовите срок, за который Вы можете сделать модель по
аминокислотной последовательности. Мы для конкурса CASP высылали модели белка
по коду в течение 24 часов. По условию конкурса, если за 24 часа любой из 30
белков не успеем прислать, то мы автоматически выбываем из конкурса.
Представьте себе, как обидно, когда ты все тридцать белков (кровь из носа)
посылаешь на международный конкурс с задержкой не больше 24 часов, а когда у
тебя принимают последний белок смотришь в Internet на сайт конкурса, видишь
свои данные вместе с другими 32 лабораториями, участвующими в конкурсе, а еще
через неделю заглядываешь на сайт, а там из 33 участников 7 вычеркнули по
непонятным причинам, в том числе и нашу группу.
.
Я не прошу Вас делать модель белка за 24 часа. Я прошу Вас назвать срок, когда
модель первого белка будет готова. Сами понимаете, хороша ложка к обеду...
.
Ваш Кушелев
nanoworld@bigfoot.com
.
.
.
П:
From: Pavel Chervonobrodov
To: Alexander Kushelev
Sent: Thursday, January 17, 2002 8:27 AM
Subject: А.Кушелеву №12 17.01.02
Уважаемый Александр Кушелев!
Да, действительно Л.Б. Меклер не видел Вашу таблицу композиционного кода.
Видел и вижу ее я, отвечая на его вопросы.
Чтобы я мог ознакомить его с Вашим сегодняшним подробным письмом
( спасибо за скорый и подробный ответ), прошу Вас подтвердить или опровергнуть
строчку из письма к Вам в части выделенных вариантов, а именно:
Буква А (аденин) -кодирует бета -нить. вар. 1,2,3. Буква С (цитозин),
кодирует альфа спираль (4/10) или бесструктурную область, вар.1.
Буква G (гуанит) кодирует по Вашему спираль 3/10 или альфа-спираль, вар.1,4.
Буква Т ( тимин) кодирует бета изгиб. вар.1,3.
У меня опасение, что мной выделены варианты ошибочно.
Ваш Павел Червонобродов.
.
K: Я же Вам дважды написал, что отдельные буквы не кодируют варианты.
Буква A(аденин) - ничего не кодирует, как и остальные буквы.
Смысл несет лишь слово (триплет), т.е. сочетание трех букв, например:
.
GGC - вар.1
GGA - вар.2
GGT - вар.3
GGG - вар.4
.
AAG - вар.1
AAA - вар.3
.
Чтобы нам не играть в игру "Испорченный телефон" вместо научной дискуссии
распечатайте текст моей научной статьи, таблицу композиционного генетического
кода и картинку с красной и синей полосами, моделями инсулина и вручите их Л.Б.
Меклеру лично, либо отправьте по обыкновенной почте. Я думаю, что это
существенно ускорит ознакомление Л.Б. с моей моделью.
.
А по телефону спросите, через сколько дней он сможет продиктовать вторичную
структуру любого из трех интересующих меня участков белка (если хочет, пусть
строит целиком), длиной 20 аминокислотных остатков.
.
Продиктовать вторичную структуру - минутное дело. Нужно всего-лишь сказать с
какого по какой номер идет участок альфа-спирали, а с какого по какой - бета-нить.
Если этих участков не один, значит придется продиктовать не два числа, а три
или четыре. Даже если участок из 20 аминокислотных остатков состоить из самых
коротких участков альфа-спирали (короче 3 не бывает) + один остаток на
поворот = 4, то 20 разделить на 4 = 5. 5 начал и 5 концов, т.е. максимум нужно
продиктовать 10 чисел. Я думаю, что это займет не больше 5 минут.
.
А назвать срок изготовления модели - одно число. Я думаю, что за минуту это
можно сделать даже при плохой телефонной связи.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020117 вечер
П: Уважаемый Александр Юрьевич!
.Когда я начал читать Лазарю Борисовичу Ваш текст, в котором Вы говорите:
.
"В инсулине по данным РСА и по программе CASP.exe есть только две субъединицы,
которые представляют собой участки альфа-спирали. Бета-нитей в инсулине не
обнаружено..." то дальше чтение было прервано, так как появилось резкое
возражение, которое по моей просьбе Л.Б. продиктовал. Привожу его.
.
"В любом обзоре, посвященном структуре и функциям инсулинов (человека и самых
различных животных) можно прочесть, что инсулин в растворе существует в виде
мономера и димера, в завимости от концентации. При концентрации меньшей 10 в
минус девятой М (моля) равновесие сдвигается в сторону распада димера на два
мономера. При 10 в минус одиннадцатой степени существует в растворе только
мономер. Это справедливо для всех инсулинов кроме инсулина морской свинки.
Инсулин морской свинки существует в растворе только в виде мономера и не
кристаллизуется.
.
Остальные инсулины кристаллизуются в виде цинк - гексамеров, в структуре
которых бета-структура сохраняется. Этот результат подтверждается и спектрами
кругового дихроизма инсулинов. В том числе и инсулина морской свинки, то есть
отсутствие альфа-спиралей и бета- структур в инсулине морской свинки при любой
его концентрации и наличие этих структур в растворах иных инсулинов при их
концентрацях указанных выше.
Димер образуется в результате контактирования друг с другом С-концевых
фрагментов В-цепи инсулина, обязательными компонентами которых являются два
рядом стоящих аминокислотных остатка фенилалаанина. Гексомер образуется тремя
молекулами димера и в нем также сохраняются эти бета - структуры.
Исключением является инсулин морской свинки. Этот инсулин не образует димеров
при любой концентрации его раствора Почему? Потому, что аминокислотная
последовательность димеробразующего фрагмента В-цепи иная. Почему эти замены не
позволяют возникнуть димеру, становится видно, если построить согласно П-К коду
ОСГК. модель димера обычного инсулина и попытаться построить димер инсулина
морской свинки согласно тому же коду.
Что касается кода открытого Вами, то из того факта, что третья буква А кодирует
и спирали, и бета-структуры, и бета-повороты следует, что нет однозначначности,
следовательно, нет кода"
.
K: Я инсулином специально не занимался. Структуру из двух альфа-спиралей мне
дал биолог из своей библиотеки, в которую этот файл попал из Протеин-банка.
Если Вы найдете в Протеин-банке другой файл инсулина, в котором будут
содержаться бета-нити, то вот Вам и противоречие между данными Протеин-банка,
которые Вы запрашивали у меня.
.
По большому счету меня структура инсулина не сильно волнует. Если в растворе
альфа-спираль переходит в бета-нить и обратно - это не проблемы таблицы
композиционного кода. Если Вы (Павел Леонович) прочли Л.Б. о том, что по
таблице идет сборка на рибосоме, то Л.Б. должен понять, что после окончания
сборки с белком можно сделать что угодно и композиционный код тут уже ни при чем.
Вы же не будете утверждать, что в чертежах автомобиля не учтено, что в соленой
воде он ржавеет быстрее, а в пресной медленнее. Тут уж дело не в чертежах,
согласитесь. Так, что образует инсулин димеры, гексамеры и прочие четвертичные
структуры, об этом в чертежах для рибосомы ничего не сказано. Объясните ему на
примере автомобиля, я думаю он все-таки поймет.
.
И объясните ему, наконец, что третья буква сама по себе ничего не кодирует.
Кодирует слово, состоящее из трех букв. Если бы вместо слов можно было бы
мычать, то тогда была бы та самая неоднозначность, о которой говорит Л.Б.
.
В таблице композиционного кода строгая однозначность: Один триплет - один
вариант. Если этого Л.Б. Понять не сможет, то таблица композиционного кода
ему не поможет. Вот такая вот рифма получается...
.
Если же Л.Б. Меклеру не хочется, чтобы существовал композиционный генетический
код и таблица, не стоит его насиловать. Пусть думает, что этого ничего нет. У
меня нет особого желания его убеждать, что это существует. В конце концов,
обходились же биологи раньше без композиционного кода, да и вообще без кода.
.
Предмет нашего с Вами разговора, если помните, состоял в том, что Л.Б. Меклеру
нужны заказы от фармацевтических фирм. При этом было обещано построение любого
белка (до 150 аминокислотных остатков) по его аминокислотной последовательности.
.
Три такие последовательности Вами получены. Я жду даты изготовления Л.Б.Меклером
первой модели. Если эта дата названа не будет, то считаю дальнейшую дискуссию
бесперспективной.
.
П: Еще вопрос, возникший при обращении к Вашей таблице композиционного
генетического кода В поз.№ 12 и 13 стоит обозначение аминокислотного остатка.
12 ATA I Ile 2 1054 72
13 ATC I Ile 1 1054 72
Я его прочел как ЛЛЕ. Л.Б. отреагировал, что нет такого аминокислотного
остатка. Как это объяснить?
Ваш Павел Червонобродов.
.
K: Объясните Л.Б., что так по-английски пишется изолейцин. А если подобный
вопрос возникнет в будущем, то прочитайте три буквы (триплет) из второй
колонки. По этим трем буквам название аминокислоты можно посмотреть в учебнике
по биологии, который, я надеюсь у Л.Б. имеется.
.
Итак, закончу письмо на оптимистической ноте, что если Л.Б. хочет меня
заинтересовать в продолжении дискусси, то пусть называет срок построения
первого из трех белков, аминокислотные последовательности которых я прислал в
предыдущем письме и на всякий случай повторяю еще раз:
.
Аминокислотная последовательность белка N1:
.
MET-LEU-THR-VAL-GLU-ILE-HIS-ASP-SER-GLN-VAL-SER-VAL-LYS-GLU-ARG-SER-GLY-VAL-SER-
GLN-LYS-SER-GLY-LYS-PRO-TYR-THR-ILE-ARG-GLU-GLN-GLU-ALA-TYR-ILE-ASP-LEU-GLY-GLY-
VAL-TYR-PRO-ALA-LEU-PHE-ASN-PHE-ASN-LEU-GLU-ASP-GLY-GLN-GLN-PRO-TYR-PRO-ALA-GLY-
LYS-TYR-ARG-LEU-HIS-PRO-ALA-SER-PHE-LYS-ILE-ASN-ASN-PHE-GLY-GLN-VAL-ALA-VAL-GLY-
ARG-VAL-LEU-LEU-GLU-SER-VAL-LYS
.
Аминокислотная последовательность белка N2:
.
MET-LYS-VAL-PHE-GLU-ARG-CYS-GLU-LEU-ALA-ARG-THR-LEU-LYS-ARG-LEU-GLY-MET-ASP-GLY-
TYR-ARG-GLY-ILE-SER-LEU-ALA-ASN-TRP-MET-CYS-LEU-ALA-LYS-TRP-GLU-SER-GLY-TYR-ASN-
THR-ARG-ALA-THR-ASN-TYR-ASN-ALA-GLY-ASP-ARG-SER-THR-ASP-TYR-GLY-ILE-PHE-GLN-ILE-
ASN-SER-ARG-TYR-TRP-CYS-ASN-ASP-GLY-LYS-THR-PRO-GLY-ALA-VAL-ASN-ALA-CYS-HIS-LEU-
SER-CYS-SER-ALA-LEU-LEU-GLN-ASP-ASN-ILE-ALA-ASP-ALA-VAL-ALA-CYS-ALA-LYS-ARG-VAL-
VAL-ARG-ASP-PRO-GLN-GLY-ILE-ARG-ALA-TRP-VAL-ALA-TRP-ARG-ASN-ARG-CYS-GLN-ASN-ARG-
ASP-VAL-ARG-GLN-TYR-VAL-GLN-GLY-CYS-GLY-VAL
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-LEU-
SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-PRO-SER-
CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-ALA-GLN-THR-
VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-ALA-VAL-ALA-PRO-
GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-HIS-ALA-ARG-TYR-LEU-
ALA-ARG-CYS-LEU
.
Вы можете сделать модели этих белков целиком, но меня в белке
N1 интересует участок с номерами аминокислотных остатков: 1...21
N2 интересует участок с номерами аминокислотных остатков: 96...117
N3 интересует участок с номерами аминокислотных остатков: 80...100
.
Если он снова оставит мой вопрос без ответа, то я вынужден буду сделать вывод,
что он не в состоянии построить модель белка.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020118 утро
M: Здравствуйте Александр Юрьевич!
.
1.Вы утверждаете , что открытый Вами композиционный генетический код реализуется
только по ходу синтеза биополипептида рибосомой. Если да, то какое Вы имеете
основание сранивать, получаемые Вами результаты с результатами РСА? Ведь
хорошо известно, что после синтеза белка рибосомой его выделяют, концетрируют,
кристаллизуют и только потом получают результат РСА .
Так какое Вы имеете основание сранивать, получаемые Вами результаты, относимые
Вами только к стадии синтеза белка рибосомой, с результатами его РСА. А ведь
именно это Вы и делаете, но РСА берете у "Вани", а потом ссылаетесь на то, что
он дал неверный результат.
.
K: Начнем с того, что большинство белков, построенных на рибосоме, как и
большинство современных автомобилей, собранных на конвейере не проходят
дальнейшей доработки покупателями (к советским автомобилям это не относится).
Если белок выделить, сконцентрировать, закристаллизовать, это аналогично тому,
что на одну стоянку поставить стройными рядами автомобили одной модели, скажем
"Мерседес-Бенц одной партии".
.
Вы уже, вероятно, догадались, что от таких манипуляций "Мерседес" "Тойотой" не
станет и руль у него, скорее всего, не отвалится. Альфа-структура, бета-структура
и смешанная структура, где в любом порядке могут чередоваться композициии 1,2,3,4
при кристаллизации в 99 случаях из 100 не меняется. Именно это свойство белков
и позволяет пользоваться РСА для выяснения его структуры. Иначе было бы просто
бессмысленно создавать Протеин-банк, если в нем нет данных о натуральных белках.
Заявление о том, что в Протеин-банке белки кристаллические, а в растворе они
имеют совершенно другую структуру, где нет ни альфа-спиралей, ни бета-нитей (из
прошлого письма) Л.Б. Меклер может выставить на посмешище биологов. Я бы тоже
мог посмеяться, но у меня есть более интересные дела.
.
Что касается РСА "от Вани", то Вы, вероятно не внимательно прочли предложение.
Я четко написал, что "Ваня" данные РСА взял из Протеин-банка. Я этот файл могу
вытащить из своего архива, прислать Вам, и Вы можете сравнивать его с тем
файлом из Протеин-банка, о котором намекал по обзорам Л.Б. Меклер. По номеру
моего файла Вы можете также проверить его наличие в Протеин-банке. Если в
Протеин-банке действительно найдется файл, в котором по Меклеру содержатся
бета-нити, то вот Вам и будет противоречие двух файлов из Протеин-банка, о
невозможности чего писал Л.Б. Меклер.
.
Еще прошу отметить, что за моими словами следуют документы из EMBL и PDB, за
словами Л.Б. Меклера я пока не вижу ни одной демонстрации. Это меня уже
перестало удивлять...
.
M: 2.Все хорошо знают, что альфа-спирали и бета-структуры образуются не по
ходу синтеза, а на второй стадии, после превращения промежуточной конформации
(жидкая) в нативную (твердая). Как это связать с Вашим утверждением об обратном?
.
K: Если Вы всед за Л.Б.Меклером утверждаете о том, что "все хорошо знают", то
советую Вам прочесть реферат Лима к его диссертации, который лет 20 назад уже
высказывал гипотезу о том, что рибосома сразу формирует вторичную структуру
белка. Мне реферат Лима передал профессор кафедры МГУ, руководитель семинара,
на котором я докладывал о композиционном генетическом коде, К.В. Шайтан. Из 60
присутствовавших биологов на этом семинаре (можете посмотреть его видеозапись
из CD-приложений к энциклопедии Наномир), ни один не относится тем "всем",
которые "хорошо знают, что альфа-спираль и бета-нить образуются на второй
стадии". Это всего-лишь старая гипотеза, которая с открытием композиционного
кода оказалась отвергнутой. Что касается утверждений Л.Б. Меклера, то очевидно,
что они слишком категоричны для того, чтобы он мог пересматривать свою точку
зрения. Переубеждать такого человека - пустое занятие. Для меня же имеют
значения не фразы типа "все хорошо знают", "весь опыт биологов", "все точнейшие
количественные методы", а конкретные аргументы. Если за словами нет демонстрации,
то я могу только улыбнуться и вспомнить фразу Д.И. Менделеева: "Сказки
рассказывать всякий горазд, а ты поди, демонстрируй!"
.
Так что, давайте не будем увязывать старую гипотезу с новыми экспериментальными
данными. Тем более, что я не собираюсь в чем-либо переубеждать Л.Б. Меклера.
Пусть он считает, что композиционного кода просто нет. Зачем напрягать Л.Б.?
.
M: 3.Вы утвкрждаете, что аминокислотный остаток триптофан может находиться
только в спирали 3/10 или альфа (4/10). Между тем, в бета-структуре лизоцима
белка куриного яйца содержится два остатка триптофана в полном противоречии с
предсказаниями композиционного кода.
.
K: Мне уже надоело воду в ступе толочь. Читайте внимательно ответ на этот самый
вопрос в прошлых письмах. Не поленюсь, вставлю из прошлых писем ответ в это
письмо.
.
Вставка вопроса Л.Б.Меклера и ответа А.Ю.Кушелева из письма N8:
.
А насколько я помню, в трехмерной молекуле лизоцима белка куриного яйца два
рядом стоящих аминокислотных остатка триптофана (64 и 65 ) входят в состав бета
- структуры этой трехмерной молекулы.
Что Вы по этому поводу можете сказать?
.
K: Как я понял, со мной уже беседует не Павел Леонович Червонобродов, а Лазарь
Борисович Меклер?
.
Павел Леонович Вам прочел мое утверждение не полностью. Я по этому поводу
написал ему следующее:
"-Если в нуклеотидной последовательности до него и после него расположены
кодоны варианта 2 или 3, то это не альфа-спираль. Если же он входит в
последовательность 1-1-1-1(4/10 альфа-спираль) или 4-4-1-4 или 1-4-4 (3/10
альфа-спираль).
Вообще, если бы Вы прочитали мою статью (вкладываю ее в письмо), то сэкономили
бы себе массу времени, т.к. все эти вопросы в статье рассмотрены.
Рибосома ставит метионин всегда под одним и тем же углом "1". Химические
взаимодействия могли бы его изменить. Меняются даже структуры аминокислот после
сборки на рибосоме. Например, после сборки коллагена Pro модифицируется до
гидроксипролина, причем модификации подвергаются больше половины аминокислотных
остатков. Однако, в случае Met химическими взаимодействиями не меняется даже
угол, т.к. Met применяется фактически лишь для изгибания альфа-спирали методом
удлинения водородной связи между группой CO и группой NH четвертой по счету
пептидной группы. Метионин встречается и в смешанной последовательности, но
рибосома его ставит всегда под углом "1". Возможно, что в каких-то случаях его
нужно ставить под другим углом. Изменить угол можно либо подставив рядом
соответствующий радикал, который развернет Met на 120 градусов по или против
часовой стрелки (при этом вариант "1" сменится на "3" или на "2" соответственно),
либо после сборки должны поработать ферменты.
Именно ферменты разрезают проинсулин на два участка (с изгибами) альфа-спирали.
Эти участки соединяются между собой дисульфидными мостиками. Программа CASP.exe
показывает только ту структуру, которая сходит с рибосомы, причем, если
химические связи ее модифицируют, то это уже другая песня. Учет химических и
других взаимодействий помогает отследить некоторые из этих процессов, но уже с
использованием других программ и методов, часть из которых вообще не
запрограммированы. Сложные модели белков мы дорабатываем вручную."
.
Понятно, что если Met можно развернуть за счет химических взаимодействий, то
Trp тоже.
.
Что касается двух Trp в бета-структуре лизоцима куриного яйца, то во-первых
один из них Tyr64, во-вторых, как я только что объяснил, после выхода белка с
рибосомы его можно модифицировать разными способами (внешними, т.е. ферментами
и внутренними, т.е. внутримолекулярным взаимодействием). В-третьих
бета-структура лизоцима - всего лишь гипотеза исследователей, интерпретирующих
РСА. Моя программа показывает, что структура лизоцима является шедевром
микроархитектуры, отличным от альфа-спирали, бета-нити, омега петли и прочих
моделей, которыми (за неимением лучшего) вынуждены сегодня пользоваться
исследователи.
.
20020118
Итак, я уже писал, что вариант 1 - это не значит альфа-спираль. Если Л.Б.Меклер
этого запомнить не может, то читайте ему мои ответы из прошлых писем. У меня на
бег по кругу нет ни времени, ни желания.
.
Прошу Вас не загружать нашу с Вами дискуссию повторением меклеровких вопросов.
Выдавайте ему на старые вопросы старые ответы. Это легко сделать следующим
образом.
.
Я вкладываю в это письмо всю нашу переписку, которая в таком виде вошла на CD
NanoWorld2002 и скоро появится на сайте. Вы дважды кликаете на файле-вложении
index8.htm. Должен запуститься браузер Internet. На экране Вы должны увидеть
текст всей переписки.
.
Далее, нажимаете на вторую кнопку в верхней строке браузера "Edit", опускаетесь
до строчки "Find on this page", вводите ключевое слово из вопроса Л.Б. Меклера,
например "лизоцим", "триптофан", "аденин" и Вы найдете этот вопрос, если он
встречался ранее. Далее распечатываете мой ответ из старого письма, вкладываете
в конверт и отправляете Л.Б. Меклеру.
.
Я помно, что он хвастался, что кроме телефона у него хорошая память. Так вот,
если он забыл, спрашивал ли он этот вопрос в предыдущих письмах, пусть он
посмотрит на коллекцию своих вопросов, которые можно прикрепить на стенке. Если
же он все-таки будет повторяться в вопросах, то Вы ему посылайте мои старые
ответы. Какой смысл загружать электронную почту повторами?
.
M: 4. Согласно композиционному коду аминокислотный остаток метионина может
входить только в состав альфа -спирали (4/10). Между тем, хорошо известно, что
первым аминокислотным остатком любого синтезируемого рибосомой белка является
метионин. Если верен композицанной код, то это означает автоматически, что
любой синтезирующийся рибосомой белок начинается с альфа-спирали, в том числе,
и чисто бета-структурные белки. Неплохо бы проверить, действительно ли в чисто
бета-структурных белках не содержится аминокислотный остаток метионина и пр. и
пр. ( )
.
K: На этот вопрос распечатайте Л.Б.Меклеру ответ из того же восьмого письма, с
которого начинается "время для прямого контакта "Меклер-Кушелев".
.
M: Тем не менее, меня лично интригует то обстоятельство, что согласно
композициооному коду, кодоны, содержащие на конце G или C, кодируют
аминокислотные остатки, входящие в состав только спиралей альфа или 3/10 и не
входящие в состав бета-структур и бета-изгибов.
.
K: Этот вопрос - тоже повтор. Ищите его в старых письмах вместе с моим ответом.
.
M: Если бы все это этим ограничивалось! Так нет, оказывается, что кодоны,
содержащие третью букву А, тоже кодируют аминокислотные остатки, входящие в
состав спиралей.
.
С другой стороны, бета-нити и бета-повороты кодируют только А и Т.
.
K: - А это уже пятикратный повтор. Сколько раз нужно повторить Л.Б.Меклеру, что
буквы A,C,G,T сами по себе углы не кодируют. Из букв складываются слова. Эти
слова типа AAA, GGC и пр. являютя командами, которые выполняет рибосома.
Представьте себе, что я Вам даю три команды: "ТОРМОЗИТЬ", "ОСТАНОВИТЬСЯ",
"РАЗВЕРНУТЬСЯ". Вы же не будете утверждать, что команда "ОСТАНОВИТЬСЯ" это то
же самое, что команда "Я". Если дойти до такого маразма, то получится, что
"ОСТАНОВИТЬСЯ" И "РАЗВЕРНУТЬСЯ" это одна и та же команда, а значит код не
однозначный, а значит его просто нет.
.
Код есть, просто в голове - каша.
.
M: Если допустить, что утверждение о том, что согласно композиционному коду
аминокислотные остатки, кодируемые триплетами, третья буква которых А входит в
состав спиралей ошибочно, то вырисовывается интригующая следующая возможность.
.
Ни третья, ни первая, ни пятая, ни десятая буква в состав спиралей, нитей, и
вообще в состав белковых молекул не входит. Буквы входят в состав ДНК. И
давайте заканчивать с композиционным кодом. Есть желание разобраться - читайте
научную статью. Нет желания читать, значит нет проблем. Я больше не буду
отвечать на вопросы, если из них будет видно, что задающий не прочел мою статью.
.
Это все-равно, что первокласснику на пальцах объяснять высшую математику. Это
можно делать только за очень большие деньги. Иначе просто перестанешь себя
уважать.
.
M: Я имею в в виду следующее обстоятельство Хорошо известно, что G-C Уотсон
-Криковская пара "сильная", ибо G и C соединяют три водородные связи, а А и Т
- слабая, ибо А и Т содиняют две водородные связи. Имея в в виду это
обстоятельство, я обратил внимание, что согласно композицитонному коду "G-C"
приводит к формированию спиралей, энергетически более выгодных структур, чем
бета-структуры и бета-изгибы, которые согласно композиционномку коду задаются
А-С парой.
.
Например, полилизиновая альфа - спираль превращается в полилизиновую бета-
структуру в результате нагревания раствора , содержащего полилизиновые
альфа-спирали
.
Этот гипотетический параллелизм нарушается кодированием триплетами, содержащими
третью букву А, также и альфа-спиралей, почему эта красивая гипотеза распадается
как карточный домик.
.
Именно эта возможная корреляция послужила причиной моего интереса к
композиционному коду.
Л.Б.Меклер
-------------------------------------------------------------------
П: Александр Юрьевич, теперь добавление от меня
.
После того как я продиктовал Л.Б. Ваши три фрагмента:
.
N1 - с номерами аминокислотных остатков: 1...21
N2 - с номерами аминокислотных остатков: 96...117
N3 - с номерами аминокислотных остатков: 80...100
.
последовательно один за одним через каждые 5 -10 минут я получал ответы, какую
структуру образует в растворе данный фрагмент как таковой, вырезанный из
структуры содержащего данный фрагмент белка.
.
Л.Б. просил иметь ввиду, что результат не означает, что каждый фрагмент
сохранит свою структуру в составе белка, ибо не исключено влияние соседних
фрагментов на его структуру.
.
Чтобы определить структуру данного фрагмета в трехмерной структуре данного
биополипептида надо построить сначала модель трехмерной молекулы данного
биополипептида, находящегося в возбужденной конформации, то есть такой, которую
она приобретает по ходу ее синтеза рибосомой.
.
Эта модель строится согласно А-А коду и осуществляется вручную в течение одного
рабочего дня. Затем рализуется А---П-К конформационный переход, согласно П-К
коду ОСГК.
.
Эта работа занимает еще один рабочий день. Именно в этой модели формируются
альфа-спирали, бета-структуры и различные изгибы, если они заданы изначально
аминокислотной последовательностью данного биополипептида.
.
Согласно полученным формулам видно, что все три фрагмента как таковые,
согласно П-К коду представляют собой альфа-спирали с элементами 3/10.
Утверждается, что нагревание растворов соответствующих пептидов приведет их к
превращению в соответствующин бета-шпильки.
.
Привожу, продиктованные мне Л.Б. Меклером, результаты.
1 2 3 4 5 6 ...
M L T V E I ...
______2 - 5
3/10
.
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Ваш Павел Червонобродов
.
K: Ну, что же, прекрасно! Наконец, я вижу ответную реакцию!
Я не понял, это предварительные результаты или структуры построены окончательно?
Если предварительные, то подожду до завершения процесса, а если окончательные,
то хотелось бы уточнить, при какой температуре должны разрушиться
альфа-спиральные участки.
.
Короче, говоря, что можно было бы сравнить с результатами РСА, ведь по
утвреждению Л.Б. Меклера его данные должны сойтись с результатами РСА, я
правильно понимаю?
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
P/S
Уважаемый Павел Леонович! Передайте Л.Б. Меклеру, что в структурах, которые он
будет Вам диктовать меня не интересуют буквы и последовательности типа:
76,77,78,79...
.
Меня интересуют только номера остатков "начало альфа-спирали" и "конец
альфа-спирали". Именно это легко сравнить с РСА. Например,
77-81
80-84
86-90
91-94
95-98
96-99
97-101
Кстати, в этой структуре N3 что означает перекрытие 95-98, 96-99, 97-101?
Это разная структура в зависимости от температуры или что-то другое?
.
Итак, уточненные для сравнения с РСА структуры я хотел бы получить в
сокращенном виде:
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Попросите Л.Б.Меклера проверить и уточнить эти данные для сравнения с РСА.
Еще раз, с уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020118 14.48
П: Уважаемый Александр Юрьевич!
.
На связь с Л.Б. Меклером выйду позже (льготное телефонное время начинается
сегодня в 13-00). И тогда, быть может, научный разговор будет продолжен. Мне
хотелось бы этого в интересах прояснения истины в состоянии проблемы фолдинга,
что по мнению самых авторитетных биологов крайне важно.
А пока хочу попросить, поскольку перепска выносится на всеобщий обзор,
исправить букву "Р" на букву "П" (где мой текст) и на букву "М" (где текст
Л.Б.Меклера)
.
К: На счет мнения авторитетных биологов и исправления букв ничего против не имею,
однако, как Вы, вероятно догадались, я лишь по ходу текстов писем, которые Вы мне
присылали догадывался, кто автор очередной строки. Истину авторства знаете лишь Вы,
поэтому предлагаю исправить буквы по Вашему усмотрению (я Вам доверяю, а сам
разобраться до конца не могу, чья фраза Ваша, а чья - Л.Б).
Я обозначал фамилии и имена латинскими буквами, т.е. P - первая буква имени
Pavel (как обозначить Ч по-английски я затруднялся решить, поэтому выбрал первую
букву имени.). Если все комбинации символов "П: " нужно заменить на "П: ", то это
делается одной командой в программе Word. Команда называется "Заменить все".
Если Вы хотите, я это сделаю, но проверьте, все ли фразы правильно помечены.
.
П: Что касается вопроса, окончательны ли результаты по трем фрагментам
аминокислотных последовательностей, присланных Вами, в комментариях к
построенным фрагментам структуры молекулы белка Л.Б.Меклером отмечено, что
окончательные результаты могут быть получены лишь в составе полной структур
молекулы.
.
Ваш Павел Червонобродов.
.
K: Ну, так передайте, пожалуйста, Л.Б.Меклеру полные последовательности, которые я
Вам прислал, а я подожду, когда Лазарь Борисович сделает окончательные модели.
Попросите его, чтобы он проинструктировал, как сравнивать его модели с данными
РСА, т.к. в данных РСА полная однозначность, т.е. либо там альфа-спираль, либо
бета-нить. В данных РСА ничего не говорится о том, что альфа спирали будут
распадаться в растворе и при нагревании. Попросите Л.Б. Меклера, чтобы он
определил структуру при тех условиях, при которых проводится РСА. Тогда
сопоставление будет правомерным и однозначным.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020118 23.00
П: Уважаемый Александр Юрьевич!
.
Л.Б.Меклер хочет увидеть сравнение посланного Вам его результата с Вашим и с РСА.
.
K: Передайте Л.Б. Меклеру, что я тоже мечтаю поскорее увидеть сравнение всех
трех моделей (Л.Б.Меклера, моей и РСА), однако для сравнения с РСА, что я думаю
главное для решения вопроса с фармацевтическими фирмами, нужно, чтобы данные
Л.Б. были сделаны именно на условия, при которых получаются данные РСА, иначе
может получиться, что мы сравниваем какие-нибудь расплавленные альфа-спирали с
кристаллическими, что приведет к неправильному сравнению. Я думаю, что Л.Б.
Заинтересован, чтобя мы с Вами убедились в соответствии его данных и данных РСА.
Это значит, что сравнивать нужно окончательные данные Л.Б.Меклера, причем
полученные именно для той температуры и концентрации, при которой проводится
РСА. Или я не прав?
.
П: Построение полных структур зависит от изготовления исходных ленточных
последовательностей аминокислотных остатков, выполняемых не мной, и это может
задержать контакт Кушелев-Меклер, что не в интересах дела.
.
K: Контакт Меклер-Кушелев может не прерываться ни на минуту. Я же не говорю,
что до построения окончательных моделей я не буду контактировать, в частности
отвечать на любые вопросы (в разумных пределах)? Что касается интересов дела,
то согласитесь, делать поспешные выводы на предварительных данных, которые я не
знаю к какой температуре и концентрации относятся, даже не понятно, жидкая это
или кристаллическая конформация (Вы писали, что это не одно и то же) - сами
понимаете чревато ошибками, а мне не хотелось бы ошибиться в серьезном деле.
.
П: Что касается вступления Л.Б Меклера в разговор с Вами, это обозначено
первый раз его фразой "Пришло время для прямого контакта между Вами и мной."
(№ 8 от13.01.02), которое заканчивается его подписью. Второй раз - в письме №13
от 17.01.02, где четыре пункта его высказываний также заканчиваются его подписью.
.
Предочитаю, чтобы исправления внесли Вы.
.
K: -Нет проблем. Изменения внесу. Если обнаружите ошибки, пишите, будем
исправлять...
П: Ваш Павел Червонобродов.
K: С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
20020118 23.36
.
.
.
20021901 14.00 Дополнительное письмо А.Кушелева
20020118 23.00 П: Уважаемый Александр Юрьевич!
.
Л.Б.Меклер хочет увидеть сравнение посланного Вам его результата с Вашим и с
РСА. Построение полных структур зависит от изготовления исходных ленточных
последовательностей аминокислотных остатков, выполняемых не мной, и это может
задержать контакт Кушелев-Меклер, что не в интересах дела.
.
20020119 14.00
K: Что касается задержки контакта, то пока Л.Б.Меклер доделывает ленточные
модели (не будем его торопить) я хотел бы продолжить беседу с Вами.
.
Давайте попытаемся начать сравнение.
Если сравнивать предварительные данные Л.Б.Меклера с данными РСА, то для меня
это означает приблизительно следующее.
.
Представьте себе, что нам нужно сравнить два автомобиля. Один из них
Протеин-банк приобрел в лаборатории РСА и поставил на своей стоянке наряду с
тысячами других автомобилей. Другой автомобиль собирает в своем помещении
Л.Б.Меклер. Л.Б. утверждает, что автомобили будут одинаковыми.
.
Однако, в настоящий момент у Л.Б.Меклера готовы лишь шасси трех будущих
автомобилей. Давайте попытаемся сравнить их с тремя шасси, которые уже
установлены на трех автомобилях Протеин-банка.
.
Из утверждения Л.Б.Меклера: ... все три фрагмента как таковые,
согласно П-К коду представляют собой альфа-спирали с элементами 3/10.
Утверждается, что нагревание растворов соответствующих пептидов приведет их к
превращению в соответствующин бета-шпильки.
.
K: Для меня это означает приблизительно следующее.
.
...все шасси, согласно П-К представляют собой шасси Альфа-Ромео (легкового
автомобиля) с шарнирами. Утверждается, что изменение условий приведет к их
превращению с шасси Бета-Мерседеса, простите, Мерседеса-Бенца (считайте
грузовик).
.
Следовательно, для сравнения такого шасси с шасси Альфа-Ромео и Мерседеса-Бенца
нужна помощь механика Л.Б., т.к. мне не хватает данных, чтобы отличить эти три
шасси одно от другого.
.
Давайте начнем с самой грубой оценки.
.
Представьте себе, что мы хотим понять, к какой категории относится данный
автомобиль: короткий и широкий Альфа-Ромео или длинный и узкий Мерседес-Бенц?
.
Пусть Л.Б.Меклер скажет, к какой категории относится 1,2,3 участки белков.
.
Участок белка N1 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N2 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N3 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
.
Т.е. на автомобильном жаргоне это будет означать, что, например,
Шасси 1 относится к легковым (бета-нить)
Шасси 2 относится к грузовым (альфа-структурным)
Шасси 3 относится к велосипедам (цикл)
.
На данный момент у меня получается:
Шасси 1 относится к грузовым (альфа-спираль) и легковым (бета-нить)
Шасси 2 относится к грузовым (альфа-спираль) и легковым (бета-нить)
Шасси 3 относится к грузовым (альфа-спираль) и легковым (бета-нить)
.
Я не могу отличить их друг от друга. Может быть Л.Б. сможет?
.
Кстати, об автомобилях.
.
В 1996 году моей работой заинтересовался один потенциальный спонсор,
который был связан с автомобильной промышленностью. Почему потенциальный?
Дело в том, что по его словам у него намечалась крупная сделка, после
которой должна была появиться кругленькая сумма, которую он хотел вложить
в усовершенствование современных автомобилей.
.
Он попросил меня составить текст, из которого ему было бы понятно, что я
могу сделать для усовершенствования современного автомобиля.
Я составил такой текст и передал ему:
.
9960310 Комплексная программа "Автомобиль - 97".
Скорость, надежность, комфорт - мечта современного человека.
Программа "Автомобиль - 97" поможет улучшить эти параметры
комплексно.
В лаборатории "Наномир" разработаны:
1. Цилиндрический катафот, позволяющий видеть отраженный свет фар
другому водителю с любого направления одинаково хорошо. В
существующих катафотах от угла падения зависит яркость
отраженного сигнала. При освещении сбоку отражение практически
отсутствует и это бывает причиной катастрофы.
2. Микроволновый источник света, позволяющий при неизменной
мощности электропитания увеличить яркость источника света и
сильно продлить срок его службы. Рабочим элементом источника
света является минерал (кварц), способный преобразовать мощность
микроволн в видимый свет. Такой излучатель не подвержен старению
и не требует ремонта и замены.
3. Микроволновый источник энергии, позволяющий:
А) Увеличить надежность электрооборудования.
В) Уменьшить вес электрооборудования.
С) Устранить недостатки химического источника тока.
D) Устранить необходимость экономии электроэнергии.
Е) Создать герметичный салон-кондиционер.
F) Создать герметичный двигатель.
G) Полностью перевести автомобиль на электропитание.
Н) Уменьшить массу основных узлов автомобиля и их число.
I) Уменьшить затраты на производство автомобиля за счет
сокращения числа технологических операций.
4. Микроволновый двигатель, позволяющий:
А) Увеличить маневренность и проходимость автомобиля.
В) Упростить ремонт за счет уменьшения веса при постоянной
массе, что позволит поднимать и ставить автомобиль на
подставку руками, не прибегая к помощи домкрата.
С) Совершать экстренный под'ем над проезжей частью, избегая
столкновения со встречным транспортом и другими
препятствиями.
D) Осуществлять парковку в труднодоступных местах.
Е) Пересекать водоемы в режиме пониженного веса.
F) Уменьшить число аварий и катастроф за счет увеличения
надежности оборудования и повышения сцепления с дорожным
покрытием (увеличение веса при неизменной массе).
5. Микроволновая печь и холодильник, увеличивающие комфорт.
6. Лазерные инструменты с автономным источником энергии,
позволяющие быстро устранять повреждения автомобиля.
7. Телеметрическое оборудование, повышающее безопасность.
8. Устройство связи "Ракушка Нептуна", позволяющая общаться в
пределах прямой видимости с комфортом (словно Вы стоите рядом и
просто разговариваете).
Наиболее интересные эксперименты, проведенные в лаборатории
"Наномир" зафиксированы в двухсерийном научнопопулярном фильме
"Путешествие в наномир" производства Центрнаучфильм.
Внедрение перечисленных разработок предполагается поэтапно.
1. Изготовление опытного образца цилиндрического катафота.
Изготовление опытного образца микроволнового источника света.
Изготовление действующего макета микроволнового источника
энергии.
Продолжительность этапа 1 год
Затраты 15 000 USD
2. Изготовление опытной партии цилиндрических катафотов.
Изготовление опытной партии микроволновых источников света.
Изготовление опытного образца источника энергии.
Продолжительность этапа 1 год
Затраты 45 000 USD
3. Внедрение цилиндрического катафота, источника света и
источника энергии.
Продолжительность этапа ?
Затраты ?
http://ftp.decsy.ru/nanoworld/index.htm
.
**********************
.
Как Вы уже, вероятно догадались, сделка у моего потенциального спонсора не
состоялась, однако из предложенной мной программы другие фирмы за шесть лет
смогли реализовать лишь аналог цилиндрического катафота и несколько
усовершенствовать телеметрическое оборудование, повышающее безопасность.
.
Поэтому, за исключением этих двух пунктов программа Автомобиль-97 актуальна
и в 2002 году. Тем более, что в ближайшее время планируется запуск микроволнового
источника энергии мощностью 1 кВт (объем установки 4 кубических сантиметра,
масса 20 грамм).
.
Эта установка в отличие от современных бензиновых двигателей, двагателей на
спирту, природном газе и водороде, будет преобразовывать внутреннюю энергию
радиоэфира (эксперимент в режиме усиления уже проведен) непосредственно в
кинетическую энергию движения автомобиля. При этом ни химических реакций, ни
ядерных производиться не будет. Чисто СВЧ-установка, похожая на микроволновую
печь.
.
Для применения в современном автомобиле для создания силы тяги придется
делать двигатель, состоящий из 50 ... 200 ячеек по киловатту. Однако, учитывая,
что при малосерийном производстве одна ячейка будет иметь себестоимость от
1.5 до 2$, себестоимость двигателя не превысит 400$.
.
Конечно, есть двигатели и дешевле, но нужно учитывать что этому двигателю не
нужен бензин и другие виды химического топлива. Автомобиль с таким двигателем
не требует заправки, т.к. подключен к внутренней энергии радиоэфира постоянно.
.
Больших денег для разворачивания широкого производства не требуется. Ячейки
двигателя изготавливаются из синтетического сапфира на двух разных станках,
размер которых 0.5 x 0.2 x 0.2 м и 0.3 x 0.2 x 0.2 м, т.е. все рабочее место
занимает 1 квадратный метр, и на нем можно производить 100 ячеек в месяц, т.е.
за месяц с одного рабочего места может сходить двигатель мощностью 100 кВт.
.
Если перейти на технологию массового производства, то себестоимость двигателя
можно снизить в 10 ... 15 раз, т.е. его стоимость не будет превышать 40$.
.
Если Вас эта тема интересует, можем параллельно с дискуссией по белкам
обсудить нюансы создания нового двигателя для автомобиля.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
Sent: Saturday, January 19, 2002 3:54 PM
Subject: А.Кушелеву №15 19.01.02 16-00
.
П: Уважаемый Александр Юрьевич!
.
Отвечаю на Ваше высказывание в предшествующем письме №14"..нужно, чтобы данные
Л.Б. Меклера были сделаны именно на условия, при которых получаются данные РСА,
иначе может получиться, что мы сравниваем какие-нибудь расплавленные
альфа-спирали с кристаллическими, что приведет к неправильному сравнению. Я
думаю, что Л.Б. заинтересован, чтобы мы с Вами убедились в соответствии его
данных и данных РСА. Это значит, что сравнивать нужно окончательные данные
Л.Б.Меклера, причем полученные именно для той температуры и концентрации, при
которой проводится РСА. Или я не прав?"
.
Да, Вы не правы. Дело в том, что по теории Л.Б.Меклера альфа-спирали
образуются в "твердой" структуре молекулы. И поэтому его результат, посланный
Вам правомерно сравнивать со структурой РСА. В этом смысле он окончательный.
И поэтому я повторяю просьбу - выслать сравнение трех структур по обсуждаемым
фрагментам (Л,Б. Меклера, Вашу и РСА ).
.
Ваш Павел Червонобродов.
.
K: Чтобы составить сравнительную таблицу нужна однозначность данных. По Меклеру
получается, что, например, в белке N3 одна из альфа-спиралей начинается с
номера 96 и кончается на номере 99, а другая начинается с номера 97, а
заканчивается на номере 101.
.
Это как понимать? С рентгеном сравнивать спираль 96-99 или 97-101? Или может
быть нужно их просуммировать и получить спираль 96-101?
.
В данных РСА таких неоднозначностей нет, поэтому нужно как-то согласовать или
дать инструкцию, как это сопоставляется.
.
Я готов выслать все три модели (Меклера, РСА и свою), но я не могу изобразить
эти две спирали в одном столбце для сравнения с другими. Получаются два столбца,
которые не подходят по размерности. Как сравнивать руки, если на них разное
количество пальцев?
.
Я предлагаю начать с самой грубой оценки.
.
Л.Б. Меклер пишет:
Участок белка N1 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N2 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N3 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
.
Тогда хотя бы будет понятно, может ли Л.Б. отличить альфа-спираль от бета-нити и цикла.
.
На автомобильном жаргоне это будет звучать так:
.
Какой из автомобилей принадлежит к легковым, какой к грузовым, а какой к
велосипедам. Если мы можем отличить грузовик от легковушки и от велосипеда, то
имеет смысл говорить о тонких различиях в моделях автомобилей, а если для нас
все-равно, что грузовик, что велосипед, то дальнейшее сравнение просто не имеет
смысла...
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020119 19.00
K: Дополнение к предыдущему письму.
.
Уважаемый Павел Леонович!
.
Несколько минут назад от меня уехал крупный биолог, который был у меня в гостях
и заинтересовался нашей перепиской с Вами.
.
Я показал ему три участка белка, которые Вы прислали. Я попросил его сказать,
какой по его мнению белок относится к альфа-спиральным, какой - к бета-нитевым,
а какой образует цикл.
.
Он долго смотрел на развернутые схемы, которые прислали Вы, потом смотрел на
сокращенные схемки, которые написал я, потом сказал, что он не понимает, что
значит перекрывание альфа-спиралей на протяжении одного участка.
.
"Я не могу понять, как может начаться спираль 97-101, если еще не кончилась
спираль 96-99?
Это скорее всего какая-то опечатка, которую нужно исправить до начала сравнения."
.
-А Вы можете сказать, какой из этих белков альфа-спиральный, какой бета, а
какой цикл?- спросил я.
"Затрудняюсь... Они все какие-то однотипные. А перекрытие альфа-спиралей в
одной цепи исключены, поэтому вероятно при передаче данных получились искажения.
Попросите Л.Б.Меклера перепроверить и прислать корректные данные".
.
После этого разговора я убедился, что не я один поставлен в затруднительное
положение. Попросите Л.Б. Меклера исправить данные. И если ему не трудно пусть
назовет, к какому классу белков относится каждый из трех участков.
.
С уважением и большой надеждой на взаимопонимание.
.
Ваш Александр Кушелев 20020119 19.16
nanoworld@bigfoot.com
.
.
.
20020119 20.04
K: Уважаемый Павел Леонович!
Я попытался исправить все буквы P: на П: и M:, однако, я не уверен, что все
сделал правильно. Если Вам не трудно, проверьте пожалуйста, т.к. текст, который
я вкладываю в это письмо будет после Вашей проверки выставлен на сервер.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
П: Уважаемый Александр Юрьевич !
.
В графическом изображении результата Л.Б. Меклера, мною Вам пересланном,
видны перекрывающиеся участки альфа спиралей и участок бета. Повтряю эту
информцию.
---------------------------------------------------------------------------
Привожу, продиктованные мне Л.Б. Меклером, результаты.
***
K: В дальнейшем они будут фигурировать в сокращенном виде:
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
---------------------------------------------------------------------------
П-К код - это часть ОСГК, определяющая процесс перехода жидкой структуры в
твердую. Жидкая трехмерная структура рождается по ходу свертывания, выходящей
из рибосомы аминокислотной последовательности. В организме человека непрерывно,
по теории Меклера, происходит процесс перехода жидкой в тврдую и обратно. В
этом процессе температура, концентрация и др. параметры играюют свою роль. Но
для сравнения трех структур ( Меклера, Вашей и РСА) эти параметры вне игры.
.
Хотелось бы увидеть, построенную Вашей компьбтерной программой, пространственную
структуру хотя бы одного фрагмента.
.
Ваш Павел Червонобродов
.
K: Уважаемый Павел Леонович!
.
Если Л.Б. Меклер будет требовать рентгеноструктурные данные до того, как
ответит на вопрос: "К какому классу относится каждый из трех участков белка?",
то я буду вынужден сделать вывод о том, что он не может отличить альфа-спираль
от бета-нити на протяжении 20 аминокислотных остатков. Если ошибка его
предсказаний достигает 20 аминокислотных остатков, то я прошу прощения за
наивность, но как можно при такой точности предсказаний говорить о совпадении
с данными РСА?!
.
С уважением,
Ваш Кушелев
nanoworld@bigfoot.com
.
.
.
20020119 23.42
П: Уважаемый Александр Юрьевич!
.
Весьма интригующая часть Вашей информации:
1. Вы сообщаете об эксперименте, чтобы "...преобразовывать внутреннюю
энергию радиоэфира (эксперимент в режиме усиления уже проведен) ".
.
Хотелось бы подробнее узнать о результатах эксперимента.
.
2. "В ближайшее время планируется запуск микроволнового источника энергии
мощностью 1 кВт (объем установки 4 кубических сантиметра, масса 20 грамм)".
.
Хотелось бы посмотреть на фото и подавалась ли заявка на патент ?
.
Ваш Павел Червонобродов
.
К: Подробности Вы можете прочитать в моей научной статье, текст которой я
вставляю в письмо. Иллюстрации вкладываю. Если возникнут вопросы, пишите. Фото
изделия, испытанного в режиме усиления тоже вкладываю в письмо. Заявки не
подавались, т.к. это не изобретение, а открытие. Технология изготовления
содержит Ноу-Хау, поэтому нет смысла ее патентовать. Мой патентовед может
защитить производство, если оно будет развернуто, но нет смысла платить за
какие-либо патенты заранее, т.к. за 2 недели до начала производства, которое
требует патентной защиты, он может оформить все документы.
.
Сами понимаете, лишних денег-то у нас нет...
.
С уважением,
Ваш Александр Кушелев
.
Актуальные проблемы современной науки № 2, 2001
.
.
Вторичная структура в формате htm
.
Верхний синий столбец - большая альфа-спираль инсулина из другого организма
(гомологичная). Верхний синий столбец также символизирует альфа-спираль по
рентгену.
.
Красный столбец - вторичная структура инсулина кролика по программе CASP.exe
.
Если Лазаря Борисовича интересует нуклеотидная и аминокислотная
последовательность инсулина человека, то он ее может взять из EMBL или другого
банка нуклеотидных последовательностей.
.
Если Л.Б. хочет увидеть результат работы программы CASP.exe на примере
нуклеотидной последовательности инсулина человека, то он может либо сам
запустить программу CASP.exe, открыть в ней файл с нуклеотидной
последовательностью инсулина человека и увидеть результат (вторичная структура
будет выглядеть приблизительно так, как на вложенном рисунке, третичная - в
виде файла в стандарте PDB), либо присылайте мне любую нуклеотидную
последовательность в любом формате (в частности можете прислать
последовательность инсулина человека), а я сам запущу программу CASP.exe, а
результаты ее работы перешлю Вам.
.
См. вложенный рисунок и вложенный файл dne с нуклеотидной последовательностью
инсулина кролика.
.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020116 вечер
П: Ниже текст, продиктванный по телефону Л.Б.Меклером.
.
M: Здравствуйте Александр Юрьевич!
.
Я живу в помещении, где есть только телефон - мой единственный выход в мир.
Все остальное у Павла Леоновича.Он специалист по автомобилям и для него
выполнение этой работы титанический труд.
.
K: Я, к сожалению, тоже живу и работаю в чужом помещении, где есть только
телефон. Поэтому весь мир для меня виден через мерцающую дырочку модемного
канала, который в России работает не каждый час... Моя мечта - выделенная линия,
но провести ее в чужое помещение нет возможности. Остается только надеяться на
спутниковый Internet, но пока не по карману...
.
M: Поэтому, если Вы хотите, чтобы я получил возможность поработать над Вашим
материалом, я должен получать его в том виде, в котором я могу с ним работать.
А именно: необходимо колиниарная запись нуклеотидной последовательности бета -
цепи инсулина любого вида животного и колиниарная запись альфа-цепи.
.
K: В инсулине по данным РСА и по программе CASP.exe есть только две субъединицы,
которые представляют собой участки альфа-спирали. Бета-нитей в инсулине не
обнаружено...
.
Коллинеарная запись нуклеотидной последовательности инсулина кролика,
содержится в файле ocinsaa.dne. На картинке, которую я прислал в прошлом письме
эта последовательность расположена в третьем столбце, который называется
DNA-Seq.
.
Если Вы не смогли ее прочесть в файле ocinsaa.dne и в третьем столбце на
иллюстрации, то могу ее вставить в текст письма:
cgcgaggtgg aggagctgca ggtggggcag gcggagctgg gcgggggccc cggcgcgggc ggcctgcagc
cctcggcgct ttatctggcc ctgcagaagc gcggcatcgt ggagcagtgt tgcaccagca tctgctcgct
ctaccagctg gagaactact gcaactaggg gtgcccccca cccacccctg cccgcgcccc ccacgccccc
cgccctcgcc cccacccaat aaacccctcc acgcgccccc
.
M: Желательно иметь полную запись гена этого животного, начиная с пре-конца,
включая коннектин пептид. Это первое.
.
K: Я Вам могу послать только эту последовательность из нуклеотидного банка EMBL.
Прибавить к ней что-либо не в моей власти. Да и зачем Вам последовательность
инсулина более длинная, чем код проинсулина? Я же Вас не прошу строить модель
инсулина?! Вы и так знаете его структуру. Вы же хотели сравнить мою модель,
заложенную в программе CASP.exe с моделью из Протеин-банка. Я Вам послал
картинку, на которой красным цветом показана структура по программе CASP.exe,
а синим цветом показана структура инсулина из Протеин-банка. Обе модели
показывают два участка альфа-спирали, разделенные поворотом (две косых
голубеньких полосочки, разделяющие красные участки альфа-спирали). Этот самый
поворот цепи удаляется ферментами. В результате из проинсулина получается
инсулин. Если Вы эту картинку не можете увидеть, то Павел Леонович, наверное,
может Вам ее прислать по обычной бумажной почте, если Вы сами не выходите в
Internet.
.
M: Второе - в виде таблицы - указание, какой вторичной структуре соответствует
А(аденин), С(цитазин), G (гуанин), U( урацил).
.
K: Из этой фразы я вывожу, что мою таблицу композиционного кода Вы еще не
видели. Конечно, можно по телефону рассказывать, как выглядит таблица
композиционного генетического кода, но это будет трудно и долго.
.
Тем более не могу понять, а как же Вы в письме N8 от 13.01.2002 писали мне
вопросы и вставляли фрагменты моей таблицы:
04 ACA T Thr 2
05 ACC T Thr 1
06 ACG T Thr 4
07 ACT T Thr 3
У меня сложилось впечатление, что Вы ее видели или по крайней мере поняли, что
по коду ACC треонин ставится по варианту 1. Если этот вариант 1 повторяется
больше 4 раз, то образуется альфа-спираль.
.
Теперь, в десятом письме Вы пишите: "какой вторичной структуре соответсвует
аденин и др.". Вы еще разок в таблицу-то загляните. Там соответствие "триплет -
вариант", а не "аденин-вариант". Каждому из 64 триплетов соответсвует либо
вариант композиции (1,2,3,4), либо остановка трансляции.
.
Если мы с Вами будем по несколько раз об одном и том же писать, то в этом
тысячелетии можем не успеть разобраться...
.
На всякий случай напомню еще раз, что меня в данный момент интересуют Ваши три
модели белков, обозначенных мною 1,2,3.
.
Повторяю полные аминокислотные последовательности этих трех белков (из ответа
на Ваше письмо N3):
.
Аминокислотная последовательность белка N1:
.
MET-LEU-THR-VAL-GLU-ILE-HIS-ASP-SER-GLN-VAL-SER-VAL-LYS-GLU-ARG-SER-GLY-VAL-SER-
GLN-LYS-SER-GLY-LYS-PRO-TYR-THR-ILE-ARG-GLU-GLN-GLU-ALA-TYR-ILE-ASP-LEU-GLY-GLY-
VAL-TYR-PRO-ALA-LEU-PHE-ASN-PHE-ASN-LEU-GLU-ASP-GLY-GLN-GLN-PRO-TYR-PRO-ALA-GLY-
LYS-TYR-ARG-LEU-HIS-PRO-ALA-SER-PHE-LYS-ILE-ASN-ASN-PHE-GLY-GLN-VAL-ALA-VAL-GLY-
ARG-VAL-LEU-LEU-GLU-SER-VAL-LYS
.
Аминокислотная последовательность белка N2:
.
MET-LYS-VAL-PHE-GLU-ARG-CYS-GLU-LEU-ALA-ARG-THR-LEU-LYS-ARG-LEU-GLY-MET-ASP-GLY-
TYR-ARG-GLY-ILE-SER-LEU-ALA-ASN-TRP-MET-CYS-LEU-ALA-LYS-TRP-GLU-SER-GLY-TYR-ASN-
THR-ARG-ALA-THR-ASN-TYR-ASN-ALA-GLY-ASP-ARG-SER-THR-ASP-TYR-GLY-ILE-PHE-GLN-ILE-
ASN-SER-ARG-TYR-TRP-CYS-ASN-ASP-GLY-LYS-THR-PRO-GLY-ALA-VAL-ASN-ALA-CYS-HIS-LEU-
SER-CYS-SER-ALA-LEU-LEU-GLN-ASP-ASN-ILE-ALA-ASP-ALA-VAL-ALA-CYS-ALA-LYS-ARG-VAL-
VAL-ARG-ASP-PRO-GLN-GLY-ILE-ARG-ALA-TRP-VAL-ALA-TRP-ARG-ASN-ARG-CYS-GLN-ASN-ARG-
ASP-VAL-ARG-GLN-TYR-VAL-GLN-GLY-CYS-GLY-VAL
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-LEU-
SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-PRO-SER-
CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-ALA-GLN-THR-
VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-ALA-VAL-ALA-PRO-
GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-HIS-ALA-ARG-TYR-LEU-
ALA-ARG-CYS-LEU
.
Вы можете сделать модели этих белков целиком, но меня в белке
N1 интересует участок с номерами аминокислотных остатков: 1...21
N2 интересует участок с номерами аминокислотных остатков: 96...117
N3 интересует участок с номерами аминокислотных остатков: 80...100
.
Еще меня интересует за какое время Вы можете сделать модель одного из этих
белков?
.
Дело в том, что у меня есть много интересных дел, от которых отрывать время мне
не хотелось бы. Другое дело, если бы Вы прислали мне модель хотя бы одного из
этих трех белков. Тогда у меня появился бы интерес и стимул. Не жалко было бы
потраченного времени. Поймите меня правильно, не могу же я тратить десятки
часов на то, чтобы, наконец понять, что Вы либо не видели мою таблицу
композиционного генетического кода, либо видели, но забыли...
.
Если Вы увидите картинку, которую я Вам послал с моей моделью (красного цвета)
и моделью из Протеин-банка (синего цвета), то Вы поймете, что они совпадают (с
точностью до ошибок интерпретации рентгена).
.
Если Вы захотите проверить лично, а не поверить мне на слово, то Вам придется
самому доставать нуклеотидную последовательность, запускать программу CASP.exe
и сравнивать полученные результаты с данными из Протеин-банка. Если Вы не
можете сами, то остается только верить... Тратить время на неэффективную беседу
типа "испорченный телефон" у меня нет возможности.
.
M: Если код, открытый Вами, поливариантин (по словам П.Л.) подтвердите
соответствие между буквами и соответствующими им вторичными структурами.
Буква А (аденин) -кодирует бета -нить. вар. 1,2,3. Буква С (цитозин),
кодирует альфа спираль (4/10) или бесструктурную область, вар.1. Буква G
(гуанит) кодирует по Вашему спираль 3/10 или альфа-спираль, вар.1,4. Буква Т
(тимин) кодирует бета изгиб. вар.1,3.
Подтвердите, пожалуйста, правильность интерпритации Павлом Леоновичем открытого
Вами кода и разработанной Вами теории. Если нет, введите,пожалйста,
соответствующие исправления.
Примите, пожалуйста, во внимание, что я располагаю только собственной памятью и
телефоном.
.
K: Повторю на всякий случай еще раз. Нет соответствия между отдельными буквами
и вариантом композиции аминокислот. Есть соответствие "Триплет-вариант".
.
Я думаю, что проще всего в Вашем случае, чтобы Павел Леонович распечатал на
принтере таблицу композиционного генетического кода, которую я еще раз привожу
в тексте письма:
.
Таблица код-остаток-вариант-частота-нота
.
N code code name subname var freq midi
.
00 AAA K Lys 3 746 66
01 AAC N Asn 1 995 71
02 AAG K Lys 1 746 66
03 AAT N Asn 3 995 71
04 ACA T Thr 2 1328 76
05 ACC T Thr 1 1328 76
06 ACG T Thr 4 1328 76
07 ACT T Thr 3 1328 76
08 AGA R Arg teta 3 591 62
09 AGC S Ser teta 1 1773 81
10 AGG R Arg teta 1 591 62
11 AGT S Ser teta 3 1773 81
12 ATA I Ile 2 1054 72
13 ATC I Ile 1 1054 72
14 ATG M Met 1 790 67
15 ATT I Ile 3 1054 72
16 CAA Q Gln 3 790 67
17 CAC H His 1 887 69
18 CAG Q Gln 1 790 67
19 CAT H His 3 887 69
20 CCA P Pro 2 3546 81
21 CCC P Pro 1 3546 81
22 CCG P Pro 4 3546 81
23 CCT P Pro 3 3546 81
24 CGA R Arg lambda 2 591 62
25 CGC R Arg lambda 1 591 62
26 CGG R Arg lambda 4 591 62
27 CGT R Arg lambda 3 591 62
28 CTA L Leu lambda 2 995 71
29 CTC L Leu lambda 1 995 71
30 CTG L Leu lambda 4 995 71
31 CTT L Leu lambda 3 995 71
32 GAA E Glu 3 790 67
33 GAC D Asp 1 995 71
34 GAG E Glu 1 790 67
35 GAT D Asp 3 995 71
36 GCA A Ala 2 3546 93
37 GCC A Ala 1 3546 93
38 GCG A Ala 4 3546 93
39 GCT A Ala 3 3546 93
40 GGA G Gly 2 395 55
41 GGC G Gly 1 395 55
42 GGG G Gly 4 395 55
43 GGT G Gly 3 395 55
44 GTA V Val 2 1579 79
45 GTC V Val 1 1579 79
46 GTG V Val 4 1579 79
47 GTT V Val 3 1579 79
48 TAA TKD 1 0 115
49 TAC Y Tyr 1 591 62
50 TAG TKD 1 0 115
51 TAT Y Tyr 3 591 62
52 TCA S Ser lambda 2 1773 81
53 TCC S Ser lambda 1 1773 81
54 TCG S Ser lambda 4 1773 81
55 TCT S Ser lambda 3 1773 81
56 TGA TKD 1 0 115
57 TGC C Cys 1 1328 76
58 TGG W Trp 1 591 62
59 TGT C Cys 3 1328 76
60 TTA L Leu teta 3 995 71
61 TTC F Phe 1 790 67
62 TTG L Leu teta 1 995 71
63 TTT F Phe 3 790 67
Вариант 1 соответствует вхождению остатка в 4/10 альфа-спираль. Одиночный
альфа-код соответствует вхождению в структуру, которая отличается от
альфа-спирали, бета-спирали, бета поворота, и представляет собой смешанную
последовательность.
Вариант 2 соответствует вхождения остатка в классический бета-слой.
Вариант 3 соответствует вхождению остатка в бета-поворот.
Вариант 4 соответствует вхождению остатка в 3/10 альфа-спираль.
.
Пусть эта таблица, распечатанная на бумаге, будет лежать у Вас перед глазами.
Я думаю, что глядя на нее у Вас не будут возникать вопросы, которые появляются
после передачи этой таблицы по телефону.
.
С Уважением и надеждой увидеть долгожданные модели трех белков (или хотя бы
одного). Вы уж назовите срок, за который Вы можете сделать модель по
аминокислотной последовательности. Мы для конкурса CASP высылали модели белка
по коду в течение 24 часов. По условию конкурса, если за 24 часа любой из 30
белков не успеем прислать, то мы автоматически выбываем из конкурса.
Представьте себе, как обидно, когда ты все тридцать белков (кровь из носа)
посылаешь на международный конкурс с задержкой не больше 24 часов, а когда у
тебя принимают последний белок смотришь в Internet на сайт конкурса, видишь
свои данные вместе с другими 32 лабораториями, участвующими в конкурсе, а еще
через неделю заглядываешь на сайт, а там из 33 участников 7 вычеркнули по
непонятным причинам, в том числе и нашу группу.
.
Я не прошу Вас делать модель белка за 24 часа. Я прошу Вас назвать срок, когда
модель первого белка будет готова. Сами понимаете, хороша ложка к обеду...
.
Ваш Кушелев
nanoworld@bigfoot.com
.
.
.
П:
From: Pavel Chervonobrodov
To: Alexander Kushelev
Sent: Thursday, January 17, 2002 8:27 AM
Subject: А.Кушелеву №12 17.01.02
Уважаемый Александр Кушелев!
Да, действительно Л.Б. Меклер не видел Вашу таблицу композиционного кода.
Видел и вижу ее я, отвечая на его вопросы.
Чтобы я мог ознакомить его с Вашим сегодняшним подробным письмом
( спасибо за скорый и подробный ответ), прошу Вас подтвердить или опровергнуть
строчку из письма к Вам в части выделенных вариантов, а именно:
Буква А (аденин) -кодирует бета -нить. вар. 1,2,3. Буква С (цитозин),
кодирует альфа спираль (4/10) или бесструктурную область, вар.1.
Буква G (гуанит) кодирует по Вашему спираль 3/10 или альфа-спираль, вар.1,4.
Буква Т ( тимин) кодирует бета изгиб. вар.1,3.
У меня опасение, что мной выделены варианты ошибочно.
Ваш Павел Червонобродов.
.
K: Я же Вам дважды написал, что отдельные буквы не кодируют варианты.
Буква A(аденин) - ничего не кодирует, как и остальные буквы.
Смысл несет лишь слово (триплет), т.е. сочетание трех букв, например:
.
GGC - вар.1
GGA - вар.2
GGT - вар.3
GGG - вар.4
.
AAG - вар.1
AAA - вар.3
.
Чтобы нам не играть в игру "Испорченный телефон" вместо научной дискуссии
распечатайте текст моей научной статьи, таблицу композиционного генетического
кода и картинку с красной и синей полосами, моделями инсулина и вручите их Л.Б.
Меклеру лично, либо отправьте по обыкновенной почте. Я думаю, что это
существенно ускорит ознакомление Л.Б. с моей моделью.
.
А по телефону спросите, через сколько дней он сможет продиктовать вторичную
структуру любого из трех интересующих меня участков белка (если хочет, пусть
строит целиком), длиной 20 аминокислотных остатков.
.
Продиктовать вторичную структуру - минутное дело. Нужно всего-лишь сказать с
какого по какой номер идет участок альфа-спирали, а с какого по какой - бета-нить.
Если этих участков не один, значит придется продиктовать не два числа, а три
или четыре. Даже если участок из 20 аминокислотных остатков состоить из самых
коротких участков альфа-спирали (короче 3 не бывает) + один остаток на
поворот = 4, то 20 разделить на 4 = 5. 5 начал и 5 концов, т.е. максимум нужно
продиктовать 10 чисел. Я думаю, что это займет не больше 5 минут.
.
А назвать срок изготовления модели - одно число. Я думаю, что за минуту это
можно сделать даже при плохой телефонной связи.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020117 вечер
П: Уважаемый Александр Юрьевич!
.Когда я начал читать Лазарю Борисовичу Ваш текст, в котором Вы говорите:
.
"В инсулине по данным РСА и по программе CASP.exe есть только две субъединицы,
которые представляют собой участки альфа-спирали. Бета-нитей в инсулине не
обнаружено..." то дальше чтение было прервано, так как появилось резкое
возражение, которое по моей просьбе Л.Б. продиктовал. Привожу его.
.
"В любом обзоре, посвященном структуре и функциям инсулинов (человека и самых
различных животных) можно прочесть, что инсулин в растворе существует в виде
мономера и димера, в завимости от концентации. При концентрации меньшей 10 в
минус девятой М (моля) равновесие сдвигается в сторону распада димера на два
мономера. При 10 в минус одиннадцатой степени существует в растворе только
мономер. Это справедливо для всех инсулинов кроме инсулина морской свинки.
Инсулин морской свинки существует в растворе только в виде мономера и не
кристаллизуется.
.
Остальные инсулины кристаллизуются в виде цинк - гексамеров, в структуре
которых бета-структура сохраняется. Этот результат подтверждается и спектрами
кругового дихроизма инсулинов. В том числе и инсулина морской свинки, то есть
отсутствие альфа-спиралей и бета- структур в инсулине морской свинки при любой
его концентрации и наличие этих структур в растворах иных инсулинов при их
концентрацях указанных выше.
Димер образуется в результате контактирования друг с другом С-концевых
фрагментов В-цепи инсулина, обязательными компонентами которых являются два
рядом стоящих аминокислотных остатка фенилалаанина. Гексомер образуется тремя
молекулами димера и в нем также сохраняются эти бета - структуры.
Исключением является инсулин морской свинки. Этот инсулин не образует димеров
при любой концентрации его раствора Почему? Потому, что аминокислотная
последовательность димеробразующего фрагмента В-цепи иная. Почему эти замены не
позволяют возникнуть димеру, становится видно, если построить согласно П-К коду
ОСГК. модель димера обычного инсулина и попытаться построить димер инсулина
морской свинки согласно тому же коду.
Что касается кода открытого Вами, то из того факта, что третья буква А кодирует
и спирали, и бета-структуры, и бета-повороты следует, что нет однозначначности,
следовательно, нет кода"
.
K: Я инсулином специально не занимался. Структуру из двух альфа-спиралей мне
дал биолог из своей библиотеки, в которую этот файл попал из Протеин-банка.
Если Вы найдете в Протеин-банке другой файл инсулина, в котором будут
содержаться бета-нити, то вот Вам и противоречие между данными Протеин-банка,
которые Вы запрашивали у меня.
.
По большому счету меня структура инсулина не сильно волнует. Если в растворе
альфа-спираль переходит в бета-нить и обратно - это не проблемы таблицы
композиционного кода. Если Вы (Павел Леонович) прочли Л.Б. о том, что по
таблице идет сборка на рибосоме, то Л.Б. должен понять, что после окончания
сборки с белком можно сделать что угодно и композиционный код тут уже ни при чем.
Вы же не будете утверждать, что в чертежах автомобиля не учтено, что в соленой
воде он ржавеет быстрее, а в пресной медленнее. Тут уж дело не в чертежах,
согласитесь. Так, что образует инсулин димеры, гексамеры и прочие четвертичные
структуры, об этом в чертежах для рибосомы ничего не сказано. Объясните ему на
примере автомобиля, я думаю он все-таки поймет.
.
И объясните ему, наконец, что третья буква сама по себе ничего не кодирует.
Кодирует слово, состоящее из трех букв. Если бы вместо слов можно было бы
мычать, то тогда была бы та самая неоднозначность, о которой говорит Л.Б.
.
В таблице композиционного кода строгая однозначность: Один триплет - один
вариант. Если этого Л.Б. Понять не сможет, то таблица композиционного кода
ему не поможет. Вот такая вот рифма получается...
.
Если же Л.Б. Меклеру не хочется, чтобы существовал композиционный генетический
код и таблица, не стоит его насиловать. Пусть думает, что этого ничего нет. У
меня нет особого желания его убеждать, что это существует. В конце концов,
обходились же биологи раньше без композиционного кода, да и вообще без кода.
.
Предмет нашего с Вами разговора, если помните, состоял в том, что Л.Б. Меклеру
нужны заказы от фармацевтических фирм. При этом было обещано построение любого
белка (до 150 аминокислотных остатков) по его аминокислотной последовательности.
.
Три такие последовательности Вами получены. Я жду даты изготовления Л.Б.Меклером
первой модели. Если эта дата названа не будет, то считаю дальнейшую дискуссию
бесперспективной.
.
П: Еще вопрос, возникший при обращении к Вашей таблице композиционного
генетического кода В поз.№ 12 и 13 стоит обозначение аминокислотного остатка.
12 ATA I Ile 2 1054 72
13 ATC I Ile 1 1054 72
Я его прочел как ЛЛЕ. Л.Б. отреагировал, что нет такого аминокислотного
остатка. Как это объяснить?
Ваш Павел Червонобродов.
.
K: Объясните Л.Б., что так по-английски пишется изолейцин. А если подобный
вопрос возникнет в будущем, то прочитайте три буквы (триплет) из второй
колонки. По этим трем буквам название аминокислоты можно посмотреть в учебнике
по биологии, который, я надеюсь у Л.Б. имеется.
.
Итак, закончу письмо на оптимистической ноте, что если Л.Б. хочет меня
заинтересовать в продолжении дискусси, то пусть называет срок построения
первого из трех белков, аминокислотные последовательности которых я прислал в
предыдущем письме и на всякий случай повторяю еще раз:
.
Аминокислотная последовательность белка N1:
.
MET-LEU-THR-VAL-GLU-ILE-HIS-ASP-SER-GLN-VAL-SER-VAL-LYS-GLU-ARG-SER-GLY-VAL-SER-
GLN-LYS-SER-GLY-LYS-PRO-TYR-THR-ILE-ARG-GLU-GLN-GLU-ALA-TYR-ILE-ASP-LEU-GLY-GLY-
VAL-TYR-PRO-ALA-LEU-PHE-ASN-PHE-ASN-LEU-GLU-ASP-GLY-GLN-GLN-PRO-TYR-PRO-ALA-GLY-
LYS-TYR-ARG-LEU-HIS-PRO-ALA-SER-PHE-LYS-ILE-ASN-ASN-PHE-GLY-GLN-VAL-ALA-VAL-GLY-
ARG-VAL-LEU-LEU-GLU-SER-VAL-LYS
.
Аминокислотная последовательность белка N2:
.
MET-LYS-VAL-PHE-GLU-ARG-CYS-GLU-LEU-ALA-ARG-THR-LEU-LYS-ARG-LEU-GLY-MET-ASP-GLY-
TYR-ARG-GLY-ILE-SER-LEU-ALA-ASN-TRP-MET-CYS-LEU-ALA-LYS-TRP-GLU-SER-GLY-TYR-ASN-
THR-ARG-ALA-THR-ASN-TYR-ASN-ALA-GLY-ASP-ARG-SER-THR-ASP-TYR-GLY-ILE-PHE-GLN-ILE-
ASN-SER-ARG-TYR-TRP-CYS-ASN-ASP-GLY-LYS-THR-PRO-GLY-ALA-VAL-ASN-ALA-CYS-HIS-LEU-
SER-CYS-SER-ALA-LEU-LEU-GLN-ASP-ASN-ILE-ALA-ASP-ALA-VAL-ALA-CYS-ALA-LYS-ARG-VAL-
VAL-ARG-ASP-PRO-GLN-GLY-ILE-ARG-ALA-TRP-VAL-ALA-TRP-ARG-ASN-ARG-CYS-GLN-ASN-ARG-
ASP-VAL-ARG-GLN-TYR-VAL-GLN-GLY-CYS-GLY-VAL
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-LEU-
SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-PRO-SER-
CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-ALA-GLN-THR-
VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-ALA-VAL-ALA-PRO-
GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-HIS-ALA-ARG-TYR-LEU-
ALA-ARG-CYS-LEU
.
Вы можете сделать модели этих белков целиком, но меня в белке
N1 интересует участок с номерами аминокислотных остатков: 1...21
N2 интересует участок с номерами аминокислотных остатков: 96...117
N3 интересует участок с номерами аминокислотных остатков: 80...100
.
Если он снова оставит мой вопрос без ответа, то я вынужден буду сделать вывод,
что он не в состоянии построить модель белка.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020118 утро
M: Здравствуйте Александр Юрьевич!
.
1.Вы утверждаете , что открытый Вами композиционный генетический код реализуется
только по ходу синтеза биополипептида рибосомой. Если да, то какое Вы имеете
основание сранивать, получаемые Вами результаты с результатами РСА? Ведь
хорошо известно, что после синтеза белка рибосомой его выделяют, концетрируют,
кристаллизуют и только потом получают результат РСА .
Так какое Вы имеете основание сранивать, получаемые Вами результаты, относимые
Вами только к стадии синтеза белка рибосомой, с результатами его РСА. А ведь
именно это Вы и делаете, но РСА берете у "Вани", а потом ссылаетесь на то, что
он дал неверный результат.
.
K: Начнем с того, что большинство белков, построенных на рибосоме, как и
большинство современных автомобилей, собранных на конвейере не проходят
дальнейшей доработки покупателями (к советским автомобилям это не относится).
Если белок выделить, сконцентрировать, закристаллизовать, это аналогично тому,
что на одну стоянку поставить стройными рядами автомобили одной модели, скажем
"Мерседес-Бенц одной партии".
.
Вы уже, вероятно, догадались, что от таких манипуляций "Мерседес" "Тойотой" не
станет и руль у него, скорее всего, не отвалится. Альфа-структура, бета-структура
и смешанная структура, где в любом порядке могут чередоваться композициии 1,2,3,4
при кристаллизации в 99 случаях из 100 не меняется. Именно это свойство белков
и позволяет пользоваться РСА для выяснения его структуры. Иначе было бы просто
бессмысленно создавать Протеин-банк, если в нем нет данных о натуральных белках.
Заявление о том, что в Протеин-банке белки кристаллические, а в растворе они
имеют совершенно другую структуру, где нет ни альфа-спиралей, ни бета-нитей (из
прошлого письма) Л.Б. Меклер может выставить на посмешище биологов. Я бы тоже
мог посмеяться, но у меня есть более интересные дела.
.
Что касается РСА "от Вани", то Вы, вероятно не внимательно прочли предложение.
Я четко написал, что "Ваня" данные РСА взял из Протеин-банка. Я этот файл могу
вытащить из своего архива, прислать Вам, и Вы можете сравнивать его с тем
файлом из Протеин-банка, о котором намекал по обзорам Л.Б. Меклер. По номеру
моего файла Вы можете также проверить его наличие в Протеин-банке. Если в
Протеин-банке действительно найдется файл, в котором по Меклеру содержатся
бета-нити, то вот Вам и будет противоречие двух файлов из Протеин-банка, о
невозможности чего писал Л.Б. Меклер.
.
Еще прошу отметить, что за моими словами следуют документы из EMBL и PDB, за
словами Л.Б. Меклера я пока не вижу ни одной демонстрации. Это меня уже
перестало удивлять...
.
M: 2.Все хорошо знают, что альфа-спирали и бета-структуры образуются не по
ходу синтеза, а на второй стадии, после превращения промежуточной конформации
(жидкая) в нативную (твердая). Как это связать с Вашим утверждением об обратном?
.
K: Если Вы всед за Л.Б.Меклером утверждаете о том, что "все хорошо знают", то
советую Вам прочесть реферат Лима к его диссертации, который лет 20 назад уже
высказывал гипотезу о том, что рибосома сразу формирует вторичную структуру
белка. Мне реферат Лима передал профессор кафедры МГУ, руководитель семинара,
на котором я докладывал о композиционном генетическом коде, К.В. Шайтан. Из 60
присутствовавших биологов на этом семинаре (можете посмотреть его видеозапись
из CD-приложений к энциклопедии Наномир), ни один не относится тем "всем",
которые "хорошо знают, что альфа-спираль и бета-нить образуются на второй
стадии". Это всего-лишь старая гипотеза, которая с открытием композиционного
кода оказалась отвергнутой. Что касается утверждений Л.Б. Меклера, то очевидно,
что они слишком категоричны для того, чтобы он мог пересматривать свою точку
зрения. Переубеждать такого человека - пустое занятие. Для меня же имеют
значения не фразы типа "все хорошо знают", "весь опыт биологов", "все точнейшие
количественные методы", а конкретные аргументы. Если за словами нет демонстрации,
то я могу только улыбнуться и вспомнить фразу Д.И. Менделеева: "Сказки
рассказывать всякий горазд, а ты поди, демонстрируй!"
.
Так что, давайте не будем увязывать старую гипотезу с новыми экспериментальными
данными. Тем более, что я не собираюсь в чем-либо переубеждать Л.Б. Меклера.
Пусть он считает, что композиционного кода просто нет. Зачем напрягать Л.Б.?
.
M: 3.Вы утвкрждаете, что аминокислотный остаток триптофан может находиться
только в спирали 3/10 или альфа (4/10). Между тем, в бета-структуре лизоцима
белка куриного яйца содержится два остатка триптофана в полном противоречии с
предсказаниями композиционного кода.
.
K: Мне уже надоело воду в ступе толочь. Читайте внимательно ответ на этот самый
вопрос в прошлых письмах. Не поленюсь, вставлю из прошлых писем ответ в это
письмо.
.
Вставка вопроса Л.Б.Меклера и ответа А.Ю.Кушелева из письма N8:
.
А насколько я помню, в трехмерной молекуле лизоцима белка куриного яйца два
рядом стоящих аминокислотных остатка триптофана (64 и 65 ) входят в состав бета
- структуры этой трехмерной молекулы.
Что Вы по этому поводу можете сказать?
.
K: Как я понял, со мной уже беседует не Павел Леонович Червонобродов, а Лазарь
Борисович Меклер?
.
Павел Леонович Вам прочел мое утверждение не полностью. Я по этому поводу
написал ему следующее:
"-Если в нуклеотидной последовательности до него и после него расположены
кодоны варианта 2 или 3, то это не альфа-спираль. Если же он входит в
последовательность 1-1-1-1(4/10 альфа-спираль) или 4-4-1-4 или 1-4-4 (3/10
альфа-спираль).
Вообще, если бы Вы прочитали мою статью (вкладываю ее в письмо), то сэкономили
бы себе массу времени, т.к. все эти вопросы в статье рассмотрены.
Рибосома ставит метионин всегда под одним и тем же углом "1". Химические
взаимодействия могли бы его изменить. Меняются даже структуры аминокислот после
сборки на рибосоме. Например, после сборки коллагена Pro модифицируется до
гидроксипролина, причем модификации подвергаются больше половины аминокислотных
остатков. Однако, в случае Met химическими взаимодействиями не меняется даже
угол, т.к. Met применяется фактически лишь для изгибания альфа-спирали методом
удлинения водородной связи между группой CO и группой NH четвертой по счету
пептидной группы. Метионин встречается и в смешанной последовательности, но
рибосома его ставит всегда под углом "1". Возможно, что в каких-то случаях его
нужно ставить под другим углом. Изменить угол можно либо подставив рядом
соответствующий радикал, который развернет Met на 120 градусов по или против
часовой стрелки (при этом вариант "1" сменится на "3" или на "2" соответственно),
либо после сборки должны поработать ферменты.
Именно ферменты разрезают проинсулин на два участка (с изгибами) альфа-спирали.
Эти участки соединяются между собой дисульфидными мостиками. Программа CASP.exe
показывает только ту структуру, которая сходит с рибосомы, причем, если
химические связи ее модифицируют, то это уже другая песня. Учет химических и
других взаимодействий помогает отследить некоторые из этих процессов, но уже с
использованием других программ и методов, часть из которых вообще не
запрограммированы. Сложные модели белков мы дорабатываем вручную."
.
Понятно, что если Met можно развернуть за счет химических взаимодействий, то
Trp тоже.
.
Что касается двух Trp в бета-структуре лизоцима куриного яйца, то во-первых
один из них Tyr64, во-вторых, как я только что объяснил, после выхода белка с
рибосомы его можно модифицировать разными способами (внешними, т.е. ферментами
и внутренними, т.е. внутримолекулярным взаимодействием). В-третьих
бета-структура лизоцима - всего лишь гипотеза исследователей, интерпретирующих
РСА. Моя программа показывает, что структура лизоцима является шедевром
микроархитектуры, отличным от альфа-спирали, бета-нити, омега петли и прочих
моделей, которыми (за неимением лучшего) вынуждены сегодня пользоваться
исследователи.
.
20020118
Итак, я уже писал, что вариант 1 - это не значит альфа-спираль. Если Л.Б.Меклер
этого запомнить не может, то читайте ему мои ответы из прошлых писем. У меня на
бег по кругу нет ни времени, ни желания.
.
Прошу Вас не загружать нашу с Вами дискуссию повторением меклеровких вопросов.
Выдавайте ему на старые вопросы старые ответы. Это легко сделать следующим
образом.
.
Я вкладываю в это письмо всю нашу переписку, которая в таком виде вошла на CD
NanoWorld2002 и скоро появится на сайте. Вы дважды кликаете на файле-вложении
index8.htm. Должен запуститься браузер Internet. На экране Вы должны увидеть
текст всей переписки.
.
Далее, нажимаете на вторую кнопку в верхней строке браузера "Edit", опускаетесь
до строчки "Find on this page", вводите ключевое слово из вопроса Л.Б. Меклера,
например "лизоцим", "триптофан", "аденин" и Вы найдете этот вопрос, если он
встречался ранее. Далее распечатываете мой ответ из старого письма, вкладываете
в конверт и отправляете Л.Б. Меклеру.
.
Я помно, что он хвастался, что кроме телефона у него хорошая память. Так вот,
если он забыл, спрашивал ли он этот вопрос в предыдущих письмах, пусть он
посмотрит на коллекцию своих вопросов, которые можно прикрепить на стенке. Если
же он все-таки будет повторяться в вопросах, то Вы ему посылайте мои старые
ответы. Какой смысл загружать электронную почту повторами?
.
M: 4. Согласно композиционному коду аминокислотный остаток метионина может
входить только в состав альфа -спирали (4/10). Между тем, хорошо известно, что
первым аминокислотным остатком любого синтезируемого рибосомой белка является
метионин. Если верен композицанной код, то это означает автоматически, что
любой синтезирующийся рибосомой белок начинается с альфа-спирали, в том числе,
и чисто бета-структурные белки. Неплохо бы проверить, действительно ли в чисто
бета-структурных белках не содержится аминокислотный остаток метионина и пр. и
пр. ( )
.
K: На этот вопрос распечатайте Л.Б.Меклеру ответ из того же восьмого письма, с
которого начинается "время для прямого контакта "Меклер-Кушелев".
.
M: Тем не менее, меня лично интригует то обстоятельство, что согласно
композициооному коду, кодоны, содержащие на конце G или C, кодируют
аминокислотные остатки, входящие в состав только спиралей альфа или 3/10 и не
входящие в состав бета-структур и бета-изгибов.
.
K: Этот вопрос - тоже повтор. Ищите его в старых письмах вместе с моим ответом.
.
M: Если бы все это этим ограничивалось! Так нет, оказывается, что кодоны,
содержащие третью букву А, тоже кодируют аминокислотные остатки, входящие в
состав спиралей.
.
С другой стороны, бета-нити и бета-повороты кодируют только А и Т.
.
K: - А это уже пятикратный повтор. Сколько раз нужно повторить Л.Б.Меклеру, что
буквы A,C,G,T сами по себе углы не кодируют. Из букв складываются слова. Эти
слова типа AAA, GGC и пр. являютя командами, которые выполняет рибосома.
Представьте себе, что я Вам даю три команды: "ТОРМОЗИТЬ", "ОСТАНОВИТЬСЯ",
"РАЗВЕРНУТЬСЯ". Вы же не будете утверждать, что команда "ОСТАНОВИТЬСЯ" это то
же самое, что команда "Я". Если дойти до такого маразма, то получится, что
"ОСТАНОВИТЬСЯ" И "РАЗВЕРНУТЬСЯ" это одна и та же команда, а значит код не
однозначный, а значит его просто нет.
.
Код есть, просто в голове - каша.
.
M: Если допустить, что утверждение о том, что согласно композиционному коду
аминокислотные остатки, кодируемые триплетами, третья буква которых А входит в
состав спиралей ошибочно, то вырисовывается интригующая следующая возможность.
.
Ни третья, ни первая, ни пятая, ни десятая буква в состав спиралей, нитей, и
вообще в состав белковых молекул не входит. Буквы входят в состав ДНК. И
давайте заканчивать с композиционным кодом. Есть желание разобраться - читайте
научную статью. Нет желания читать, значит нет проблем. Я больше не буду
отвечать на вопросы, если из них будет видно, что задающий не прочел мою статью.
.
Это все-равно, что первокласснику на пальцах объяснять высшую математику. Это
можно делать только за очень большие деньги. Иначе просто перестанешь себя
уважать.
.
M: Я имею в в виду следующее обстоятельство Хорошо известно, что G-C Уотсон
-Криковская пара "сильная", ибо G и C соединяют три водородные связи, а А и Т
- слабая, ибо А и Т содиняют две водородные связи. Имея в в виду это
обстоятельство, я обратил внимание, что согласно композицитонному коду "G-C"
приводит к формированию спиралей, энергетически более выгодных структур, чем
бета-структуры и бета-изгибы, которые согласно композиционномку коду задаются
А-С парой.
.
Например, полилизиновая альфа - спираль превращается в полилизиновую бета-
структуру в результате нагревания раствора , содержащего полилизиновые
альфа-спирали
.
Этот гипотетический параллелизм нарушается кодированием триплетами, содержащими
третью букву А, также и альфа-спиралей, почему эта красивая гипотеза распадается
как карточный домик.
.
Именно эта возможная корреляция послужила причиной моего интереса к
композиционному коду.
Л.Б.Меклер
-------------------------------------------------------------------
П: Александр Юрьевич, теперь добавление от меня
.
После того как я продиктовал Л.Б. Ваши три фрагмента:
.
N1 - с номерами аминокислотных остатков: 1...21
N2 - с номерами аминокислотных остатков: 96...117
N3 - с номерами аминокислотных остатков: 80...100
.
последовательно один за одним через каждые 5 -10 минут я получал ответы, какую
структуру образует в растворе данный фрагмент как таковой, вырезанный из
структуры содержащего данный фрагмент белка.
.
Л.Б. просил иметь ввиду, что результат не означает, что каждый фрагмент
сохранит свою структуру в составе белка, ибо не исключено влияние соседних
фрагментов на его структуру.
.
Чтобы определить структуру данного фрагмета в трехмерной структуре данного
биополипептида надо построить сначала модель трехмерной молекулы данного
биополипептида, находящегося в возбужденной конформации, то есть такой, которую
она приобретает по ходу ее синтеза рибосомой.
.
Эта модель строится согласно А-А коду и осуществляется вручную в течение одного
рабочего дня. Затем рализуется А---П-К конформационный переход, согласно П-К
коду ОСГК.
.
Эта работа занимает еще один рабочий день. Именно в этой модели формируются
альфа-спирали, бета-структуры и различные изгибы, если они заданы изначально
аминокислотной последовательностью данного биополипептида.
.
Согласно полученным формулам видно, что все три фрагмента как таковые,
согласно П-К коду представляют собой альфа-спирали с элементами 3/10.
Утверждается, что нагревание растворов соответствующих пептидов приведет их к
превращению в соответствующин бета-шпильки.
.
Привожу, продиктованные мне Л.Б. Меклером, результаты.
1 2 3 4 5 6 ...
M L T V E I ...
______2 - 5
3/10
.
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Ваш Павел Червонобродов
.
K: Ну, что же, прекрасно! Наконец, я вижу ответную реакцию!
Я не понял, это предварительные результаты или структуры построены окончательно?
Если предварительные, то подожду до завершения процесса, а если окончательные,
то хотелось бы уточнить, при какой температуре должны разрушиться
альфа-спиральные участки.
.
Короче, говоря, что можно было бы сравнить с результатами РСА, ведь по
утвреждению Л.Б. Меклера его данные должны сойтись с результатами РСА, я
правильно понимаю?
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
P/S
Уважаемый Павел Леонович! Передайте Л.Б. Меклеру, что в структурах, которые он
будет Вам диктовать меня не интересуют буквы и последовательности типа:
76,77,78,79...
.
Меня интересуют только номера остатков "начало альфа-спирали" и "конец
альфа-спирали". Именно это легко сравнить с РСА. Например,
77-81
80-84
86-90
91-94
95-98
96-99
97-101
Кстати, в этой структуре N3 что означает перекрытие 95-98, 96-99, 97-101?
Это разная структура в зависимости от температуры или что-то другое?
.
Итак, уточненные для сравнения с РСА структуры я хотел бы получить в
сокращенном виде:
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Попросите Л.Б.Меклера проверить и уточнить эти данные для сравнения с РСА.
Еще раз, с уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020118 14.48
П: Уважаемый Александр Юрьевич!
.
На связь с Л.Б. Меклером выйду позже (льготное телефонное время начинается
сегодня в 13-00). И тогда, быть может, научный разговор будет продолжен. Мне
хотелось бы этого в интересах прояснения истины в состоянии проблемы фолдинга,
что по мнению самых авторитетных биологов крайне важно.
А пока хочу попросить, поскольку перепска выносится на всеобщий обзор,
исправить букву "Р" на букву "П" (где мой текст) и на букву "М" (где текст
Л.Б.Меклера)
.
К: На счет мнения авторитетных биологов и исправления букв ничего против не имею,
однако, как Вы, вероятно догадались, я лишь по ходу текстов писем, которые Вы мне
присылали догадывался, кто автор очередной строки. Истину авторства знаете лишь Вы,
поэтому предлагаю исправить буквы по Вашему усмотрению (я Вам доверяю, а сам
разобраться до конца не могу, чья фраза Ваша, а чья - Л.Б).
Я обозначал фамилии и имена латинскими буквами, т.е. P - первая буква имени
Pavel (как обозначить Ч по-английски я затруднялся решить, поэтому выбрал первую
букву имени.). Если все комбинации символов "П: " нужно заменить на "П: ", то это
делается одной командой в программе Word. Команда называется "Заменить все".
Если Вы хотите, я это сделаю, но проверьте, все ли фразы правильно помечены.
.
П: Что касается вопроса, окончательны ли результаты по трем фрагментам
аминокислотных последовательностей, присланных Вами, в комментариях к
построенным фрагментам структуры молекулы белка Л.Б.Меклером отмечено, что
окончательные результаты могут быть получены лишь в составе полной структур
молекулы.
.
Ваш Павел Червонобродов.
.
K: Ну, так передайте, пожалуйста, Л.Б.Меклеру полные последовательности, которые я
Вам прислал, а я подожду, когда Лазарь Борисович сделает окончательные модели.
Попросите его, чтобы он проинструктировал, как сравнивать его модели с данными
РСА, т.к. в данных РСА полная однозначность, т.е. либо там альфа-спираль, либо
бета-нить. В данных РСА ничего не говорится о том, что альфа спирали будут
распадаться в растворе и при нагревании. Попросите Л.Б. Меклера, чтобы он
определил структуру при тех условиях, при которых проводится РСА. Тогда
сопоставление будет правомерным и однозначным.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020118 23.00
П: Уважаемый Александр Юрьевич!
.
Л.Б.Меклер хочет увидеть сравнение посланного Вам его результата с Вашим и с РСА.
.
K: Передайте Л.Б. Меклеру, что я тоже мечтаю поскорее увидеть сравнение всех
трех моделей (Л.Б.Меклера, моей и РСА), однако для сравнения с РСА, что я думаю
главное для решения вопроса с фармацевтическими фирмами, нужно, чтобы данные
Л.Б. были сделаны именно на условия, при которых получаются данные РСА, иначе
может получиться, что мы сравниваем какие-нибудь расплавленные альфа-спирали с
кристаллическими, что приведет к неправильному сравнению. Я думаю, что Л.Б.
Заинтересован, чтобя мы с Вами убедились в соответствии его данных и данных РСА.
Это значит, что сравнивать нужно окончательные данные Л.Б.Меклера, причем
полученные именно для той температуры и концентрации, при которой проводится
РСА. Или я не прав?
.
П: Построение полных структур зависит от изготовления исходных ленточных
последовательностей аминокислотных остатков, выполняемых не мной, и это может
задержать контакт Кушелев-Меклер, что не в интересах дела.
.
K: Контакт Меклер-Кушелев может не прерываться ни на минуту. Я же не говорю,
что до построения окончательных моделей я не буду контактировать, в частности
отвечать на любые вопросы (в разумных пределах)? Что касается интересов дела,
то согласитесь, делать поспешные выводы на предварительных данных, которые я не
знаю к какой температуре и концентрации относятся, даже не понятно, жидкая это
или кристаллическая конформация (Вы писали, что это не одно и то же) - сами
понимаете чревато ошибками, а мне не хотелось бы ошибиться в серьезном деле.
.
П: Что касается вступления Л.Б Меклера в разговор с Вами, это обозначено
первый раз его фразой "Пришло время для прямого контакта между Вами и мной."
(№ 8 от13.01.02), которое заканчивается его подписью. Второй раз - в письме №13
от 17.01.02, где четыре пункта его высказываний также заканчиваются его подписью.
.
Предочитаю, чтобы исправления внесли Вы.
.
K: -Нет проблем. Изменения внесу. Если обнаружите ошибки, пишите, будем
исправлять...
П: Ваш Павел Червонобродов.
K: С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
20020118 23.36
.
.
.
20021901 14.00 Дополнительное письмо А.Кушелева
20020118 23.00 П: Уважаемый Александр Юрьевич!
.
Л.Б.Меклер хочет увидеть сравнение посланного Вам его результата с Вашим и с
РСА. Построение полных структур зависит от изготовления исходных ленточных
последовательностей аминокислотных остатков, выполняемых не мной, и это может
задержать контакт Кушелев-Меклер, что не в интересах дела.
.
20020119 14.00
K: Что касается задержки контакта, то пока Л.Б.Меклер доделывает ленточные
модели (не будем его торопить) я хотел бы продолжить беседу с Вами.
.
Давайте попытаемся начать сравнение.
Если сравнивать предварительные данные Л.Б.Меклера с данными РСА, то для меня
это означает приблизительно следующее.
.
Представьте себе, что нам нужно сравнить два автомобиля. Один из них
Протеин-банк приобрел в лаборатории РСА и поставил на своей стоянке наряду с
тысячами других автомобилей. Другой автомобиль собирает в своем помещении
Л.Б.Меклер. Л.Б. утверждает, что автомобили будут одинаковыми.
.
Однако, в настоящий момент у Л.Б.Меклера готовы лишь шасси трех будущих
автомобилей. Давайте попытаемся сравнить их с тремя шасси, которые уже
установлены на трех автомобилях Протеин-банка.
.
Из утверждения Л.Б.Меклера: ... все три фрагмента как таковые,
согласно П-К коду представляют собой альфа-спирали с элементами 3/10.
Утверждается, что нагревание растворов соответствующих пептидов приведет их к
превращению в соответствующин бета-шпильки.
.
K: Для меня это означает приблизительно следующее.
.
...все шасси, согласно П-К представляют собой шасси Альфа-Ромео (легкового
автомобиля) с шарнирами. Утверждается, что изменение условий приведет к их
превращению с шасси Бета-Мерседеса, простите, Мерседеса-Бенца (считайте
грузовик).
.
Следовательно, для сравнения такого шасси с шасси Альфа-Ромео и Мерседеса-Бенца
нужна помощь механика Л.Б., т.к. мне не хватает данных, чтобы отличить эти три
шасси одно от другого.
.
Давайте начнем с самой грубой оценки.
.
Представьте себе, что мы хотим понять, к какой категории относится данный
автомобиль: короткий и широкий Альфа-Ромео или длинный и узкий Мерседес-Бенц?
.
Пусть Л.Б.Меклер скажет, к какой категории относится 1,2,3 участки белков.
.
Участок белка N1 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N2 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N3 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
.
Т.е. на автомобильном жаргоне это будет означать, что, например,
Шасси 1 относится к легковым (бета-нить)
Шасси 2 относится к грузовым (альфа-структурным)
Шасси 3 относится к велосипедам (цикл)
.
На данный момент у меня получается:
Шасси 1 относится к грузовым (альфа-спираль) и легковым (бета-нить)
Шасси 2 относится к грузовым (альфа-спираль) и легковым (бета-нить)
Шасси 3 относится к грузовым (альфа-спираль) и легковым (бета-нить)
.
Я не могу отличить их друг от друга. Может быть Л.Б. сможет?
.
Кстати, об автомобилях.
.
В 1996 году моей работой заинтересовался один потенциальный спонсор,
который был связан с автомобильной промышленностью. Почему потенциальный?
Дело в том, что по его словам у него намечалась крупная сделка, после
которой должна была появиться кругленькая сумма, которую он хотел вложить
в усовершенствование современных автомобилей.
.
Он попросил меня составить текст, из которого ему было бы понятно, что я
могу сделать для усовершенствования современного автомобиля.
Я составил такой текст и передал ему:
.
9960310 Комплексная программа "Автомобиль - 97".
Скорость, надежность, комфорт - мечта современного человека.
Программа "Автомобиль - 97" поможет улучшить эти параметры
комплексно.
В лаборатории "Наномир" разработаны:
1. Цилиндрический катафот, позволяющий видеть отраженный свет фар
другому водителю с любого направления одинаково хорошо. В
существующих катафотах от угла падения зависит яркость
отраженного сигнала. При освещении сбоку отражение практически
отсутствует и это бывает причиной катастрофы.
2. Микроволновый источник света, позволяющий при неизменной
мощности электропитания увеличить яркость источника света и
сильно продлить срок его службы. Рабочим элементом источника
света является минерал (кварц), способный преобразовать мощность
микроволн в видимый свет. Такой излучатель не подвержен старению
и не требует ремонта и замены.
3. Микроволновый источник энергии, позволяющий:
А) Увеличить надежность электрооборудования.
В) Уменьшить вес электрооборудования.
С) Устранить недостатки химического источника тока.
D) Устранить необходимость экономии электроэнергии.
Е) Создать герметичный салон-кондиционер.
F) Создать герметичный двигатель.
G) Полностью перевести автомобиль на электропитание.
Н) Уменьшить массу основных узлов автомобиля и их число.
I) Уменьшить затраты на производство автомобиля за счет
сокращения числа технологических операций.
4. Микроволновый двигатель, позволяющий:
А) Увеличить маневренность и проходимость автомобиля.
В) Упростить ремонт за счет уменьшения веса при постоянной
массе, что позволит поднимать и ставить автомобиль на
подставку руками, не прибегая к помощи домкрата.
С) Совершать экстренный под'ем над проезжей частью, избегая
столкновения со встречным транспортом и другими
препятствиями.
D) Осуществлять парковку в труднодоступных местах.
Е) Пересекать водоемы в режиме пониженного веса.
F) Уменьшить число аварий и катастроф за счет увеличения
надежности оборудования и повышения сцепления с дорожным
покрытием (увеличение веса при неизменной массе).
5. Микроволновая печь и холодильник, увеличивающие комфорт.
6. Лазерные инструменты с автономным источником энергии,
позволяющие быстро устранять повреждения автомобиля.
7. Телеметрическое оборудование, повышающее безопасность.
8. Устройство связи "Ракушка Нептуна", позволяющая общаться в
пределах прямой видимости с комфортом (словно Вы стоите рядом и
просто разговариваете).
Наиболее интересные эксперименты, проведенные в лаборатории
"Наномир" зафиксированы в двухсерийном научнопопулярном фильме
"Путешествие в наномир" производства Центрнаучфильм.
Внедрение перечисленных разработок предполагается поэтапно.
1. Изготовление опытного образца цилиндрического катафота.
Изготовление опытного образца микроволнового источника света.
Изготовление действующего макета микроволнового источника
энергии.
Продолжительность этапа 1 год
Затраты 15 000 USD
2. Изготовление опытной партии цилиндрических катафотов.
Изготовление опытной партии микроволновых источников света.
Изготовление опытного образца источника энергии.
Продолжительность этапа 1 год
Затраты 45 000 USD
3. Внедрение цилиндрического катафота, источника света и
источника энергии.
Продолжительность этапа ?
Затраты ?
http://ftp.decsy.ru/nanoworld/index.htm
.
**********************
.
Как Вы уже, вероятно догадались, сделка у моего потенциального спонсора не
состоялась, однако из предложенной мной программы другие фирмы за шесть лет
смогли реализовать лишь аналог цилиндрического катафота и несколько
усовершенствовать телеметрическое оборудование, повышающее безопасность.
.
Поэтому, за исключением этих двух пунктов программа Автомобиль-97 актуальна
и в 2002 году. Тем более, что в ближайшее время планируется запуск микроволнового
источника энергии мощностью 1 кВт (объем установки 4 кубических сантиметра,
масса 20 грамм).
.
Эта установка в отличие от современных бензиновых двигателей, двагателей на
спирту, природном газе и водороде, будет преобразовывать внутреннюю энергию
радиоэфира (эксперимент в режиме усиления уже проведен) непосредственно в
кинетическую энергию движения автомобиля. При этом ни химических реакций, ни
ядерных производиться не будет. Чисто СВЧ-установка, похожая на микроволновую
печь.
.
Для применения в современном автомобиле для создания силы тяги придется
делать двигатель, состоящий из 50 ... 200 ячеек по киловатту. Однако, учитывая,
что при малосерийном производстве одна ячейка будет иметь себестоимость от
1.5 до 2$, себестоимость двигателя не превысит 400$.
.
Конечно, есть двигатели и дешевле, но нужно учитывать что этому двигателю не
нужен бензин и другие виды химического топлива. Автомобиль с таким двигателем
не требует заправки, т.к. подключен к внутренней энергии радиоэфира постоянно.
.
Больших денег для разворачивания широкого производства не требуется. Ячейки
двигателя изготавливаются из синтетического сапфира на двух разных станках,
размер которых 0.5 x 0.2 x 0.2 м и 0.3 x 0.2 x 0.2 м, т.е. все рабочее место
занимает 1 квадратный метр, и на нем можно производить 100 ячеек в месяц, т.е.
за месяц с одного рабочего места может сходить двигатель мощностью 100 кВт.
.
Если перейти на технологию массового производства, то себестоимость двигателя
можно снизить в 10 ... 15 раз, т.е. его стоимость не будет превышать 40$.
.
Если Вас эта тема интересует, можем параллельно с дискуссией по белкам
обсудить нюансы создания нового двигателя для автомобиля.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
Sent: Saturday, January 19, 2002 3:54 PM
Subject: А.Кушелеву №15 19.01.02 16-00
.
П: Уважаемый Александр Юрьевич!
.
Отвечаю на Ваше высказывание в предшествующем письме №14"..нужно, чтобы данные
Л.Б. Меклера были сделаны именно на условия, при которых получаются данные РСА,
иначе может получиться, что мы сравниваем какие-нибудь расплавленные
альфа-спирали с кристаллическими, что приведет к неправильному сравнению. Я
думаю, что Л.Б. заинтересован, чтобы мы с Вами убедились в соответствии его
данных и данных РСА. Это значит, что сравнивать нужно окончательные данные
Л.Б.Меклера, причем полученные именно для той температуры и концентрации, при
которой проводится РСА. Или я не прав?"
.
Да, Вы не правы. Дело в том, что по теории Л.Б.Меклера альфа-спирали
образуются в "твердой" структуре молекулы. И поэтому его результат, посланный
Вам правомерно сравнивать со структурой РСА. В этом смысле он окончательный.
И поэтому я повторяю просьбу - выслать сравнение трех структур по обсуждаемым
фрагментам (Л,Б. Меклера, Вашу и РСА ).
.
Ваш Павел Червонобродов.
.
K: Чтобы составить сравнительную таблицу нужна однозначность данных. По Меклеру
получается, что, например, в белке N3 одна из альфа-спиралей начинается с
номера 96 и кончается на номере 99, а другая начинается с номера 97, а
заканчивается на номере 101.
.
Это как понимать? С рентгеном сравнивать спираль 96-99 или 97-101? Или может
быть нужно их просуммировать и получить спираль 96-101?
.
В данных РСА таких неоднозначностей нет, поэтому нужно как-то согласовать или
дать инструкцию, как это сопоставляется.
.
Я готов выслать все три модели (Меклера, РСА и свою), но я не могу изобразить
эти две спирали в одном столбце для сравнения с другими. Получаются два столбца,
которые не подходят по размерности. Как сравнивать руки, если на них разное
количество пальцев?
.
Я предлагаю начать с самой грубой оценки.
.
Л.Б. Меклер пишет:
Участок белка N1 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N2 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
Участок белка N3 относится к альфа-спиральным, бета-нитевым, цикл (ненужное из трех зачеркнуть)
.
Тогда хотя бы будет понятно, может ли Л.Б. отличить альфа-спираль от бета-нити и цикла.
.
На автомобильном жаргоне это будет звучать так:
.
Какой из автомобилей принадлежит к легковым, какой к грузовым, а какой к
велосипедам. Если мы можем отличить грузовик от легковушки и от велосипеда, то
имеет смысл говорить о тонких различиях в моделях автомобилей, а если для нас
все-равно, что грузовик, что велосипед, то дальнейшее сравнение просто не имеет
смысла...
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020119 19.00
K: Дополнение к предыдущему письму.
.
Уважаемый Павел Леонович!
.
Несколько минут назад от меня уехал крупный биолог, который был у меня в гостях
и заинтересовался нашей перепиской с Вами.
.
Я показал ему три участка белка, которые Вы прислали. Я попросил его сказать,
какой по его мнению белок относится к альфа-спиральным, какой - к бета-нитевым,
а какой образует цикл.
.
Он долго смотрел на развернутые схемы, которые прислали Вы, потом смотрел на
сокращенные схемки, которые написал я, потом сказал, что он не понимает, что
значит перекрывание альфа-спиралей на протяжении одного участка.
.
"Я не могу понять, как может начаться спираль 97-101, если еще не кончилась
спираль 96-99?
Это скорее всего какая-то опечатка, которую нужно исправить до начала сравнения."
.
-А Вы можете сказать, какой из этих белков альфа-спиральный, какой бета, а
какой цикл?- спросил я.
"Затрудняюсь... Они все какие-то однотипные. А перекрытие альфа-спиралей в
одной цепи исключены, поэтому вероятно при передаче данных получились искажения.
Попросите Л.Б.Меклера перепроверить и прислать корректные данные".
.
После этого разговора я убедился, что не я один поставлен в затруднительное
положение. Попросите Л.Б. Меклера исправить данные. И если ему не трудно пусть
назовет, к какому классу белков относится каждый из трех участков.
.
С уважением и большой надеждой на взаимопонимание.
.
Ваш Александр Кушелев 20020119 19.16
nanoworld@bigfoot.com
.
.
.
20020119 20.04
K: Уважаемый Павел Леонович!
Я попытался исправить все буквы P: на П: и M:, однако, я не уверен, что все
сделал правильно. Если Вам не трудно, проверьте пожалуйста, т.к. текст, который
я вкладываю в это письмо будет после Вашей проверки выставлен на сервер.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
П: Уважаемый Александр Юрьевич !
.
В графическом изображении результата Л.Б. Меклера, мною Вам пересланном,
видны перекрывающиеся участки альфа спиралей и участок бета. Повтряю эту
информцию.
---------------------------------------------------------------------------
Привожу, продиктованные мне Л.Б. Меклером, результаты.
***
K: В дальнейшем они будут фигурировать в сокращенном виде:
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
---------------------------------------------------------------------------
П-К код - это часть ОСГК, определяющая процесс перехода жидкой структуры в
твердую. Жидкая трехмерная структура рождается по ходу свертывания, выходящей
из рибосомы аминокислотной последовательности. В организме человека непрерывно,
по теории Меклера, происходит процесс перехода жидкой в тврдую и обратно. В
этом процессе температура, концентрация и др. параметры играюют свою роль. Но
для сравнения трех структур ( Меклера, Вашей и РСА) эти параметры вне игры.
.
Хотелось бы увидеть, построенную Вашей компьбтерной программой, пространственную
структуру хотя бы одного фрагмента.
.
Ваш Павел Червонобродов
.
K: Уважаемый Павел Леонович!
.
Если Л.Б. Меклер будет требовать рентгеноструктурные данные до того, как
ответит на вопрос: "К какому классу относится каждый из трех участков белка?",
то я буду вынужден сделать вывод о том, что он не может отличить альфа-спираль
от бета-нити на протяжении 20 аминокислотных остатков. Если ошибка его
предсказаний достигает 20 аминокислотных остатков, то я прошу прощения за
наивность, но как можно при такой точности предсказаний говорить о совпадении
с данными РСА?!
.
С уважением,
Ваш Кушелев
nanoworld@bigfoot.com
.
.
.
20020119 23.42
П: Уважаемый Александр Юрьевич!
.
Весьма интригующая часть Вашей информации:
1. Вы сообщаете об эксперименте, чтобы "...преобразовывать внутреннюю
энергию радиоэфира (эксперимент в режиме усиления уже проведен) ".
.
Хотелось бы подробнее узнать о результатах эксперимента.
.
2. "В ближайшее время планируется запуск микроволнового источника энергии
мощностью 1 кВт (объем установки 4 кубических сантиметра, масса 20 грамм)".
.
Хотелось бы посмотреть на фото и подавалась ли заявка на патент ?
.
Ваш Павел Червонобродов
.
К: Подробности Вы можете прочитать в моей научной статье, текст которой я
вставляю в письмо. Иллюстрации вкладываю. Если возникнут вопросы, пишите. Фото
изделия, испытанного в режиме усиления тоже вкладываю в письмо. Заявки не
подавались, т.к. это не изобретение, а открытие. Технология изготовления
содержит Ноу-Хау, поэтому нет смысла ее патентовать. Мой патентовед может
защитить производство, если оно будет развернуто, но нет смысла платить за
какие-либо патенты заранее, т.к. за 2 недели до начала производства, которое
требует патентной защиты, он может оформить все документы.
.
Сами понимаете, лишних денег-то у нас нет...
.
С уважением,
Ваш Александр Кушелев
.
Актуальные проблемы современной науки № 2, 2001
.
 .
.
.
20020120 00.12
П: Уважаемый Александр Юрьевич!
.
Речь у нас с Вами о пептидах - фрагментах, вырезанных из белка. Описок нет -
сказал Л.Б.Меклер.
От продолжения дискуссии он воздерживается (занят неотложными делами).
Как я понял его, для пояснения вопроса о перекрытиях надо более подробно
говорить о П-К коде с использованием понятия "компонента связности". Моей
квалификации для продолжения разговора недостаточно.
Ваш Павел Червонобродов.
.
K: -Ну и ничего страшного. Компоненты связности - вещь хорошая, можно обсудить,
когда у Л.Б. будет время и желание. Меня интересует в первую очередь вопрос:
"Может ли Л.Б. отличить альфа-спираль длиной 20 аминокислотных остатков от
бета-нити длиной 20 аминокислотных остатков?". Ответ на этот вопрос напрямую
связан с определением Л.Б.Меклером, какой из 3 участков, данные по которым он
мне прислал, являются альфа-спиралью, т.е. в каком из трех участков идет
непрерывная альфа-спираль от начала до конца (все 20 остатков)? Какой из тех же
3 участков является бета-нитью, т.е. в в каком из трех участков идет
непрерывная бета-нить, т.е. не встречается ни одного альфа-спирального участка
на протяжении всех 20 остатков? И, наконец, какой из тех же трех участков
образует цикл лизоцима?
.
Если Л.Б. сможет ответить на эти три вопроса, значит он может непрерывную
альфа-спираль длиной 20 остатков отличить от непрерывной бета-нити такой же
длины. Если он на эти 3 вопроса не ответит, значит по полученным им самим
данным он сам не может отличить.
.
После того, как он назовет, например, что
Участок N1 - непрерывная альфа-спираль (это я к примеру),
Участок N2 - непрерывная бета-нить (это я тоже например),
Участок N3 - цикл, в котором последний остаток соединяется с первым (опять например).
.
Если его ответы совпадут с данными РСА (и другими надежными методами
исследований), то я скажу: "Лазарь Борисович, Вы - Бог!". Если не совпадут, ну
что же, ни у кого на Земле этого пока не получается... (У меня идеального
совпадения с данными РСА нет, хотя с точностью до 5 остатков, т.е. с реальной
точностью РСА совпадение имеется). Но, согласитесь, что ошибка на 5 остатков
все же лучше, чем на 20...
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020120 12.02 Дополнительное письмо
K: Уважаемый Павел Леонович!
Если Вы хотите увидеть вторичные структуры белков, которые пытается предсказать
Л.Б.Меклер, то см. вложенный файл-картинку.
Эти три структуры, вычисленные программой CASP.exe находятся в полном
соответствии со структурными данными из разных источников (Протеин-банк,
научные статьи, которые можно найти, имея полное название белков и организмов,
из которых эти белки выделены. Сразу после окончательного ответа Л.Б. Меклера,
какая из трех картинок относится к участку N1,N2,N3, я вышлю Вам ту же картинку
с полными названиями белков.
После этого будет не трудно проверить структурные данные, которые я Вам посылаю.
Совпадет ли с ними предсказание Л.Б.Меклера или нет мы тоже сразу увидим.
.
Объясните, пожалуйста Л.Б., чтобы он не принимал близко к сердцу, если его
прогноз не подтвердится. Я же не хочу его обидеть или унизить. Я просто хочу
достоверно установить: "Работает секретное Ноу-Хау Л.Б.Меклера или нет?".
.
Если оно работает в том смысле, о котором мы с Вами говорили, то можно говорить
о сотрудничестве на уровне предсказания структур для фармацевтических фирм.
Если оно в этом смысле не работает, но работает как-то по-другому, то можно
обсудить полезные свойства, проверить их, если они действительно присутствуют
в Ноу-Хау Л.Б.Меклера, то можно обсуждать сотрудничество с учетом этого факта.
.
В любом случае, совпадут структуры по Меклеру со структурами из других
источников (РСА, статьи) или не совпадут, наши с Вами отношения, я надеюсь не
изменятся, т.к. в науке обид не бывает. Л.Б.Меклера я уважаю, т.к. даже если он
и ошибается, то искренне. Не будет же человек годами в нищете работать ради
того, чтобы кого-то умышленно ввести в заблуждение? Я думаю, что нет.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
См. вложенный файл-картинку:
.
.
.
20020120 00.12
П: Уважаемый Александр Юрьевич!
.
Речь у нас с Вами о пептидах - фрагментах, вырезанных из белка. Описок нет -
сказал Л.Б.Меклер.
От продолжения дискуссии он воздерживается (занят неотложными делами).
Как я понял его, для пояснения вопроса о перекрытиях надо более подробно
говорить о П-К коде с использованием понятия "компонента связности". Моей
квалификации для продолжения разговора недостаточно.
Ваш Павел Червонобродов.
.
K: -Ну и ничего страшного. Компоненты связности - вещь хорошая, можно обсудить,
когда у Л.Б. будет время и желание. Меня интересует в первую очередь вопрос:
"Может ли Л.Б. отличить альфа-спираль длиной 20 аминокислотных остатков от
бета-нити длиной 20 аминокислотных остатков?". Ответ на этот вопрос напрямую
связан с определением Л.Б.Меклером, какой из 3 участков, данные по которым он
мне прислал, являются альфа-спиралью, т.е. в каком из трех участков идет
непрерывная альфа-спираль от начала до конца (все 20 остатков)? Какой из тех же
3 участков является бета-нитью, т.е. в в каком из трех участков идет
непрерывная бета-нить, т.е. не встречается ни одного альфа-спирального участка
на протяжении всех 20 остатков? И, наконец, какой из тех же трех участков
образует цикл лизоцима?
.
Если Л.Б. сможет ответить на эти три вопроса, значит он может непрерывную
альфа-спираль длиной 20 остатков отличить от непрерывной бета-нити такой же
длины. Если он на эти 3 вопроса не ответит, значит по полученным им самим
данным он сам не может отличить.
.
После того, как он назовет, например, что
Участок N1 - непрерывная альфа-спираль (это я к примеру),
Участок N2 - непрерывная бета-нить (это я тоже например),
Участок N3 - цикл, в котором последний остаток соединяется с первым (опять например).
.
Если его ответы совпадут с данными РСА (и другими надежными методами
исследований), то я скажу: "Лазарь Борисович, Вы - Бог!". Если не совпадут, ну
что же, ни у кого на Земле этого пока не получается... (У меня идеального
совпадения с данными РСА нет, хотя с точностью до 5 остатков, т.е. с реальной
точностью РСА совпадение имеется). Но, согласитесь, что ошибка на 5 остатков
все же лучше, чем на 20...
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020120 12.02 Дополнительное письмо
K: Уважаемый Павел Леонович!
Если Вы хотите увидеть вторичные структуры белков, которые пытается предсказать
Л.Б.Меклер, то см. вложенный файл-картинку.
Эти три структуры, вычисленные программой CASP.exe находятся в полном
соответствии со структурными данными из разных источников (Протеин-банк,
научные статьи, которые можно найти, имея полное название белков и организмов,
из которых эти белки выделены. Сразу после окончательного ответа Л.Б. Меклера,
какая из трех картинок относится к участку N1,N2,N3, я вышлю Вам ту же картинку
с полными названиями белков.
После этого будет не трудно проверить структурные данные, которые я Вам посылаю.
Совпадет ли с ними предсказание Л.Б.Меклера или нет мы тоже сразу увидим.
.
Объясните, пожалуйста Л.Б., чтобы он не принимал близко к сердцу, если его
прогноз не подтвердится. Я же не хочу его обидеть или унизить. Я просто хочу
достоверно установить: "Работает секретное Ноу-Хау Л.Б.Меклера или нет?".
.
Если оно работает в том смысле, о котором мы с Вами говорили, то можно говорить
о сотрудничестве на уровне предсказания структур для фармацевтических фирм.
Если оно в этом смысле не работает, но работает как-то по-другому, то можно
обсудить полезные свойства, проверить их, если они действительно присутствуют
в Ноу-Хау Л.Б.Меклера, то можно обсуждать сотрудничество с учетом этого факта.
.
В любом случае, совпадут структуры по Меклеру со структурами из других
источников (РСА, статьи) или не совпадут, наши с Вами отношения, я надеюсь не
изменятся, т.к. в науке обид не бывает. Л.Б.Меклера я уважаю, т.к. даже если он
и ошибается, то искренне. Не будет же человек годами в нищете работать ради
того, чтобы кого-то умышленно ввести в заблуждение? Я думаю, что нет.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
См. вложенный файл-картинку:
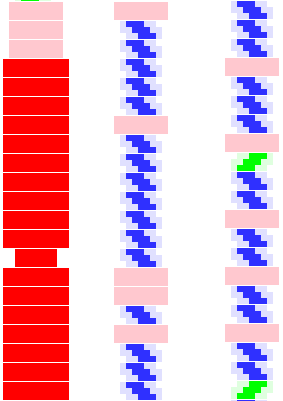 .
.
.
20020120 15.40
П: Уважаемый Александр Юрьевич!
.
Я начал читать нашу переписку, там есть описки в текстах. Например, (см. ниже -
должно быть "повторяю"). В этом результате есть ошибка: я опустил,
продиктованную мне Л.Б.Меклером, альфа -спираль 4/10 между № 12 и №16.
.
Чтобы исправить допущенные описки я должен получить от Вас весь текст в формате,
где смогу вносить исправления. В присланном мне, попробовал, не получается.
.
В графическом изображении результата Л.Б. Меклера, мною Вам пересланном,
видны перекрывающиеся участки альфа спиралей и участок бета. Повтряю эту
информцию.
-------------------------------------------------------------------------
Привожу, продиктованные мне Л.Б. Меклером, результаты.
N1
2-5
4-8
7-11
10-14
12-16
21-25
.
K: Правильно?
.
.
.
20020121 00.30
П: Уважаемый Александр Юрьевич!
.
Отечаю на Ваш вопрос, получив пояснения Л.Б.Меклера .
.
Обратитесь к известной Вам статье ("Природа",1993, №5), отсканированной в
Вашей энциклопе -дии.Там на странице 42 помещен граф, представляющий собой
изображение ОСГК ( А-А, П-К и остальные четыре кода), в том числе и граф А-А
кода, опубликованного Л.Б.Меклером за 12 лет до этого. Впервые этот граф
был опубликован Р.Г. Идлис в журнале Всес. хим. об-ва им. Д.И.Менделеева
(ссылка в статье имеется). Через 10 лет граф был повторен американцами (ссылка
там же ), но без ссылки на Р.Г.Идлис. Она им об этом написала. Они извинились
и после этого цитируют ее.
.
Этот граф дал возможность понять Л.Б.Меклеру физико-химическую природу А-А кода,
ранее опубликованного только в виде таблицы. Сущность этого понимания отражена
в данном графе соответствующими стрелками и цветами кружков, символизирующими
соответствующие аминокислотные остатки. Затем Л.Б.Меклер, анализируя
физико-химические основы формирования трехмерных нативных молекул
биополипептидов и белков по их моделям, опубликованным в Протеин банке РСА,
открыл код, согласно которому формируются альфа - спирали и бета -структуры,
предсказанные Л.Полингом и Р.Кори (ссылки в той же статье) и впервые
подтвердившими реальность этого предсказания Кендрю, Перутцем (альфа- -спирали)
и Давидом Филлипсом (бета -структуры) ( ссылки там же ) , а затем и многими
тысячами других исследователей ( см. Протеин банк ).
.
Этот код Л.Б.Меклер и Р.Г. Идлис назвали П - К кодом в честь Полинга и Кори.
.
Согласно этому коду образуются альфа -спирали и бета -структуры и фиксированные
изгибы. Согласно этому коду узнают друг друга и связываются. друг с другом
только аминокислотные остатки, относящиеся к одному и тому же компоненту
связности. Справедливость этого утверждения была подтверждена результатами
статистического анализа, проведенного частично Л.Б.Меклером и Р.Г.Идлис( см.
соответствующую таблицу на стр.38), а в основном д .ф.м. наук. Сливняком.,
специалистом в области статистического анализа, объектом которого был весь
Протеин банк.
.
Построение Л.Б.Меклером соответствующих моделей согласно этому коду,
предъявленное на ряде конкурсов, дополнительно подтвердило верность этого
кода. В том числе, на конкурсе (есть письменное подтверждение - поздравление
автора построения модели РСА - американского исследователя Бусьера, в ответ на
посланные ему А-А и П-К модели белка РТП длиной 129 аминокислотных остатка
плюс модель димера этого белка, представленного Л.Б Мелером, несмотря на
отсутствие упоминания в условиях конкурса образования этим белком димера, что
особо подчеркнул Бусьер).
.
Речь идет о конкурсе, в котором участвовали Вы, и где Вас исключили, как Вы
сказали, без объяснения причин. При желании можно выслать Вам копию письма
Бусьера, как приложение к нашему разговору в Вашем сайте. Кроме того, можно
прислать копии всех документов, свидетельствующих о результатах конкурсов, в
которых участвовал Л.Б.Меклер, чтобы с ними ознакомилась общественность хотя бы
через Ваш сайт.
.
Разумеется, Л.Б. Меклер может отличить альфа-спираль от бета-нити, причем не
длиной 20 аминокислотных остатков, как Вы пишите, а в пределах точности, с
которой он строит согласно П-К коду нативную (твердую) модель, в которой сдвиг
от истинного значения (согласно РСА), не превышает один-два аминокислотных
остатка, обычно в большую сторону.
.
Теперь несколько слов, чтобы преодолеть представление о невозможности
перекрытия одной альфа-спиралью другую.
.
Л.Б.Меклер посоветовал из бумажной ленты, имитирующей данную аминокислотную
последовательность ( см. фото в том же журнале), свернуть спираль согласно
посланных Вам по Вашему предложению трех фрагметов пептидов, соеденив
скобками аминокислотные остатки так , как это указано на этих схемах ( скобка
означает, направленные к друг к другу боковые группы соответствующих
аминокислотных остатков, образующих друг с другом данную П-К связь согласно П-К
коду, и тогда становится ясным образование перекрытий, формирующих данную
защитную рубашку.
.
Итак, согласно разработанной Л.Б.Меклером теории самоорганизации,
функционирования и эволюции биополимеров с рибосом как "корабли со стапелей"
сходят трехмерные молекулы биополипептидов или белков, находящиеся в
возбужденном состоянии, т.е. именно в том состоянии, в котором они подобно
химическим молекулам могут взаимодействовать друг с другом. Затем происходит
взаимодействие либо друг с другом в свободном состоянии, т. е образуют димеры
или более высокой степени олигомеры, которые переходят в основное состояние,
т.е именно в то, которое выявляется при помощи РСА или ЯМР анализа, и которое
принято называть нативным.
.
Если длина полипептидной цепи того или иного биоролипептида или белка,
синтезируемого рибосомой превышает критическую массу, необходимую для
обратимого А-А --- П- К конформационного перехода, то этот процесс реализуется
по ходу дальнейшего синтеза данного биополимера рибосомой данной многодоменной
трехмерной его молекулы.
.
Надо помнить, справедливость предсказания Л.Полинга и Р.Кори была
подтверждена РСА. Спираль формируется в результате образования водородных
связей межуду СО и NH группами остова полипептидной цепи, направленными вдоль
спирали и находящимися внутри ее.
.
Строго говоря, такая спираль не просуществовала бы даже доли секунды, ибо
данные водордные связи энергетически близки водородным связям, образующимся
между молекулами воды, а точнее, даже чуть меньше, ибо водородная связь,
образуемая NH группой , слабее водородной связи, образуемой ОН группой.
.
Ситуацию спасает существование у полимеров аминокислот боковых групп
гидрофобных структур, формирующих защитные рубашки вокруг альфа и иных спиралей
и бета - структур этих биополимеров., благодоря существованию П-К кода
сотканных столь плотно, что через них в принципе не могут проникнуть к
защищенным этими рубашками водородным связям этих вторичных структур,
пытающиеся атаковать их молекулы воды.
.
Ваш Павел Червонобродов
.
К: Я преклоняюсь перед красотой изложения материала Вами, уважаемый Павел
Леонович, однако я не вижу ответа на интересующие меня вопросы. Вопросы до боли
простые. Вы уже увидели, что один из участков состоит из одной единственной
альфа-спирали, длинной 20 аминокислотных остатков. В другом участке не
встечается ни одной альфа-спирали. Третий участок образует цикл, который
обнаружен не только РСА, но и методами структурной химии.
.
Если Л.Б. Меклер хочет узнать названия этих трех белков и результат сравнения с
РСА и другими надежными данными, то пусть он все-таки скажет. К какому из трех
участков относится каждая из трех картинок. Какой из участков - непрерывная
альфа-спираль, какой из участков - бета-нить без включений альфа-спиралей и
какой из участков образует цикл.
.
Если Л.Б. не способен ответить на повторяемые мной вопросы, то я вынужден буду
заключить, что он не способен отличить альфа-спираль, длиной 20 АО от бета-нити
такой же длины. В таком случае его ошибка составляет не один-два остатка, как
Вы пишите, а все 20, причем если белок будет иметь размер 20 АО, то ошибка
модели Л.Б. составит весь белок. Или я не прав?
.
С уважением, Ваш Александр Кушелев.
Надеюсь, что Л.Б. сможет отличить участок типа половины инсулина от половины
фиброина. Иначе все рассказы о конкурсах будут выглядеть по меньшей мере
смешными. Это все-равно, что специалист по автомобилям заверяет, что может
отличить пятисотый мерседес от шестисотого, а на поверку не может отличить
грузовик от велосипеда. Моя маленькая дочка называет эту ситуацию одним словом
"прокака"...
.
Еще раз напоминаю, что я жду всего лишь три цифры: номер альфа-спирального
участка белка (красная картинка слева), номер участка бета-нитевого белка
(в середине) и номер участка, замкнутого в цикл (справа).
.
Без этих трех цифр триумф теории Л.Б.Меклера не возможен.
.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020120 15.40
П: Уважаемый Александр Юрьевич!
.
Я начал читать нашу переписку, там есть описки в текстах. Например, (см. ниже -
должно быть "повторяю"). В этом результате есть ошибка: я опустил,
продиктованную мне Л.Б.Меклером, альфа -спираль 4/10 между № 12 и №16.
.
Чтобы исправить допущенные описки я должен получить от Вас весь текст в формате,
где смогу вносить исправления. В присланном мне, попробовал, не получается.
.
В графическом изображении результата Л.Б. Меклера, мною Вам пересланном,
видны перекрывающиеся участки альфа спиралей и участок бета. Повтряю эту
информцию.
-------------------------------------------------------------------------
Привожу, продиктованные мне Л.Б. Меклером, результаты.
N1
2-5
4-8
7-11
10-14
12-16
21-25
.
K: Правильно?
.
.
.
20020121 00.30
П: Уважаемый Александр Юрьевич!
.
Отечаю на Ваш вопрос, получив пояснения Л.Б.Меклера .
.
Обратитесь к известной Вам статье ("Природа",1993, №5), отсканированной в
Вашей энциклопе -дии.Там на странице 42 помещен граф, представляющий собой
изображение ОСГК ( А-А, П-К и остальные четыре кода), в том числе и граф А-А
кода, опубликованного Л.Б.Меклером за 12 лет до этого. Впервые этот граф
был опубликован Р.Г. Идлис в журнале Всес. хим. об-ва им. Д.И.Менделеева
(ссылка в статье имеется). Через 10 лет граф был повторен американцами (ссылка
там же ), но без ссылки на Р.Г.Идлис. Она им об этом написала. Они извинились
и после этого цитируют ее.
.
Этот граф дал возможность понять Л.Б.Меклеру физико-химическую природу А-А кода,
ранее опубликованного только в виде таблицы. Сущность этого понимания отражена
в данном графе соответствующими стрелками и цветами кружков, символизирующими
соответствующие аминокислотные остатки. Затем Л.Б.Меклер, анализируя
физико-химические основы формирования трехмерных нативных молекул
биополипептидов и белков по их моделям, опубликованным в Протеин банке РСА,
открыл код, согласно которому формируются альфа - спирали и бета -структуры,
предсказанные Л.Полингом и Р.Кори (ссылки в той же статье) и впервые
подтвердившими реальность этого предсказания Кендрю, Перутцем (альфа- -спирали)
и Давидом Филлипсом (бета -структуры) ( ссылки там же ) , а затем и многими
тысячами других исследователей ( см. Протеин банк ).
.
Этот код Л.Б.Меклер и Р.Г. Идлис назвали П - К кодом в честь Полинга и Кори.
.
Согласно этому коду образуются альфа -спирали и бета -структуры и фиксированные
изгибы. Согласно этому коду узнают друг друга и связываются. друг с другом
только аминокислотные остатки, относящиеся к одному и тому же компоненту
связности. Справедливость этого утверждения была подтверждена результатами
статистического анализа, проведенного частично Л.Б.Меклером и Р.Г.Идлис( см.
соответствующую таблицу на стр.38), а в основном д .ф.м. наук. Сливняком.,
специалистом в области статистического анализа, объектом которого был весь
Протеин банк.
.
Построение Л.Б.Меклером соответствующих моделей согласно этому коду,
предъявленное на ряде конкурсов, дополнительно подтвердило верность этого
кода. В том числе, на конкурсе (есть письменное подтверждение - поздравление
автора построения модели РСА - американского исследователя Бусьера, в ответ на
посланные ему А-А и П-К модели белка РТП длиной 129 аминокислотных остатка
плюс модель димера этого белка, представленного Л.Б Мелером, несмотря на
отсутствие упоминания в условиях конкурса образования этим белком димера, что
особо подчеркнул Бусьер).
.
Речь идет о конкурсе, в котором участвовали Вы, и где Вас исключили, как Вы
сказали, без объяснения причин. При желании можно выслать Вам копию письма
Бусьера, как приложение к нашему разговору в Вашем сайте. Кроме того, можно
прислать копии всех документов, свидетельствующих о результатах конкурсов, в
которых участвовал Л.Б.Меклер, чтобы с ними ознакомилась общественность хотя бы
через Ваш сайт.
.
Разумеется, Л.Б. Меклер может отличить альфа-спираль от бета-нити, причем не
длиной 20 аминокислотных остатков, как Вы пишите, а в пределах точности, с
которой он строит согласно П-К коду нативную (твердую) модель, в которой сдвиг
от истинного значения (согласно РСА), не превышает один-два аминокислотных
остатка, обычно в большую сторону.
.
Теперь несколько слов, чтобы преодолеть представление о невозможности
перекрытия одной альфа-спиралью другую.
.
Л.Б.Меклер посоветовал из бумажной ленты, имитирующей данную аминокислотную
последовательность ( см. фото в том же журнале), свернуть спираль согласно
посланных Вам по Вашему предложению трех фрагметов пептидов, соеденив
скобками аминокислотные остатки так , как это указано на этих схемах ( скобка
означает, направленные к друг к другу боковые группы соответствующих
аминокислотных остатков, образующих друг с другом данную П-К связь согласно П-К
коду, и тогда становится ясным образование перекрытий, формирующих данную
защитную рубашку.
.
Итак, согласно разработанной Л.Б.Меклером теории самоорганизации,
функционирования и эволюции биополимеров с рибосом как "корабли со стапелей"
сходят трехмерные молекулы биополипептидов или белков, находящиеся в
возбужденном состоянии, т.е. именно в том состоянии, в котором они подобно
химическим молекулам могут взаимодействовать друг с другом. Затем происходит
взаимодействие либо друг с другом в свободном состоянии, т. е образуют димеры
или более высокой степени олигомеры, которые переходят в основное состояние,
т.е именно в то, которое выявляется при помощи РСА или ЯМР анализа, и которое
принято называть нативным.
.
Если длина полипептидной цепи того или иного биоролипептида или белка,
синтезируемого рибосомой превышает критическую массу, необходимую для
обратимого А-А --- П- К конформационного перехода, то этот процесс реализуется
по ходу дальнейшего синтеза данного биополимера рибосомой данной многодоменной
трехмерной его молекулы.
.
Надо помнить, справедливость предсказания Л.Полинга и Р.Кори была
подтверждена РСА. Спираль формируется в результате образования водородных
связей межуду СО и NH группами остова полипептидной цепи, направленными вдоль
спирали и находящимися внутри ее.
.
Строго говоря, такая спираль не просуществовала бы даже доли секунды, ибо
данные водордные связи энергетически близки водородным связям, образующимся
между молекулами воды, а точнее, даже чуть меньше, ибо водородная связь,
образуемая NH группой , слабее водородной связи, образуемой ОН группой.
.
Ситуацию спасает существование у полимеров аминокислот боковых групп
гидрофобных структур, формирующих защитные рубашки вокруг альфа и иных спиралей
и бета - структур этих биополимеров., благодоря существованию П-К кода
сотканных столь плотно, что через них в принципе не могут проникнуть к
защищенным этими рубашками водородным связям этих вторичных структур,
пытающиеся атаковать их молекулы воды.
.
Ваш Павел Червонобродов
.
К: Я преклоняюсь перед красотой изложения материала Вами, уважаемый Павел
Леонович, однако я не вижу ответа на интересующие меня вопросы. Вопросы до боли
простые. Вы уже увидели, что один из участков состоит из одной единственной
альфа-спирали, длинной 20 аминокислотных остатков. В другом участке не
встечается ни одной альфа-спирали. Третий участок образует цикл, который
обнаружен не только РСА, но и методами структурной химии.
.
Если Л.Б. Меклер хочет узнать названия этих трех белков и результат сравнения с
РСА и другими надежными данными, то пусть он все-таки скажет. К какому из трех
участков относится каждая из трех картинок. Какой из участков - непрерывная
альфа-спираль, какой из участков - бета-нить без включений альфа-спиралей и
какой из участков образует цикл.
.
Если Л.Б. не способен ответить на повторяемые мной вопросы, то я вынужден буду
заключить, что он не способен отличить альфа-спираль, длиной 20 АО от бета-нити
такой же длины. В таком случае его ошибка составляет не один-два остатка, как
Вы пишите, а все 20, причем если белок будет иметь размер 20 АО, то ошибка
модели Л.Б. составит весь белок. Или я не прав?
.
С уважением, Ваш Александр Кушелев.
Надеюсь, что Л.Б. сможет отличить участок типа половины инсулина от половины
фиброина. Иначе все рассказы о конкурсах будут выглядеть по меньшей мере
смешными. Это все-равно, что специалист по автомобилям заверяет, что может
отличить пятисотый мерседес от шестисотого, а на поверку не может отличить
грузовик от велосипеда. Моя маленькая дочка называет эту ситуацию одним словом
"прокака"...
.
Еще раз напоминаю, что я жду всего лишь три цифры: номер альфа-спирального
участка белка (красная картинка слева), номер участка бета-нитевого белка
(в середине) и номер участка, замкнутого в цикл (справа).
.
Без этих трех цифр триумф теории Л.Б.Меклера не возможен.
.
Ваш Александр Кушелев
nanoworld@bigfoot.com
 .
.
.
20020121 00.45
П: Александр Юрьевич!
Какие аминокислотные остатки?
.
K: Вы хотите получить ответ до того, как Л.Б.Меклер решит задачу? Как только
будут пронумерованы столбцы (наример, красный - 1, средний - 2, правый - 3),
сразу же я проставлю и номера и аминокислотные остатки. Нельзя же решать
задачу, подсмотрев у меня ответ, или я не прав?
.
П: Как выглядят составляющие структуры?
.
K: Альфа-спиральный участок - красного цвета (слева). Бета-спиральный - в
середине. Цикл - справа. В данных РСА красный участок обозначен, как
HELIX от N до M, где N - начало участка из 20 аминокислотных остатков,
а M - конец участка из 20 аминокислотных остатков. M - N = 20.
.
П: Как выглядят эти же структуры РСА?
.
K: Если Вы о третичной структуре, то в виде координат атомов, а если Вы
спрашиваете о данных РСА по вторичной структуре, то в виде слова HELIX
(спираль) или SHEET (бета-слой), TURN (поворот).
.
В моей научной статье Вы можете найти такой пример. Привожу его для наглядности
в текте:
.
N Code Name Name Var Secondary
Kushelev PDB Kushelev Structure
. PDB
18 GGC Gly GLY 1
19 AGT Ser SER 3
20 GGA Gly GLY 2
21 TAC Tyr TYR 1 HELIX
22 GGC Gly GLY 1 HELIX
23 GGT Gly GLY 3 HELIX
24 GCC Ala ALA 1 HELIX
25 GTC Val VAL 1 HELIX
26 GCC Ala ALA 1 HELIX
27 GCG Ala ALA 4 HELIX
28 CTG Leu LEU 4 HELIX
29 CGG Arg ARG 4 HELIX
30 CTG Leu LEU 4 HELIX
31 ACG Thr THR 4 HELIX
32 CAG Gln GLN 1 HELIX
33 GCC Ala ALA 1
34 GGT Gly GLY 3
35 ATC Ile VAL 1
.
На этой иллюстрации из моей научной статьи по моей модели альфа-спираль
начинается с 24 и заканчивается на 33, т.е. в сокращенном виде это будет
записано так:
.
Участок N
24-33
.
По данным Протеин-банка альфа-спираль обнаружена там, где написано слово HELIX,
т.е. по данным PDB альфа-спираль начинается с 21 и заканчивается на 32, т.е. в
сокращенном виде это будет записано так:
21-32.
.
Сравнивая мою модель с данными РСА можно заметить, что они расходятся на три АО
в начале и на один АО в конце. Когда я начинаю беседовать с биологами (как Вы
уже догадались я биологией занимаюсь по случаю, а свою программу CASP.exe
использую в рекламных целях), то первым вопросом обычно бывает: "А почему такое
большое расхождение? Ведь рентген ошибается не больше, чем на один АО?
.
Мой ответ Вы, вероятно, помните из нашей переписки. Я им объясняю, что ошибка
на один ангстрем - это ошибка на один атом, который может принадлежать другому
АО, который может принадлежать другому витку альфа-спирали, поэтому ошибаясь в
пространстве на один атом РСА ошибается может быть на 4 АО вдоль линейной
последовательности. Все специалисты, с которыми я общался на эту тему вынуждены
были признать правомерность моих аргументов, после чего отношение к моей модели
и программе становилось серьезным.
.
Если Вы читали это Л.Б.Меклеру, то он на это вообще не отреагировал, т.к. в
предыдущем письме было написано:
"сдвиг от истинного значения (согласно РСА), не превышает один-два
аминокислотных остатка, обычно в большую сторону."
.
Из этого утверждения я заключаю, что Л.Б.Меклер просто проигнорировал мои
аргументы. А я Вам писал, что слишком хорошее совпадение меня настораживает. Вы
еще ответили тогда:
"...я предвижу резко отрицательное отношение Л.Б.Меклера на Ваше утверждение
"Если у Л.Б. Меклера совпал с рентгенологами лишь один белок, тем лучше для
Л.Б. Меклера. Если много, то плохо, т.к. для меня это означает, что совпали две
ошибочные системы интерпретации"."
.
K: Л.Б.Меклер не отреагировал на эти аргументы, а ведь один маленький факт
может опрокинуть грандиозную теорию...
.
П: Или это неправомерные вопросы?
.
K: Вы можете задавать любые вопросы, однако, заранее ответ на экзамене не дают...
.
Короче, жду, когда Л.Б. пронумерует столбцы на картинке, которую я на всякий
случай (для напоминания актуальности этих вопросов) вкладываю снова в письмо.
.
С уважением к Вам и Л.Б.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020121 00.45
П: Александр Юрьевич!
Какие аминокислотные остатки?
.
K: Вы хотите получить ответ до того, как Л.Б.Меклер решит задачу? Как только
будут пронумерованы столбцы (наример, красный - 1, средний - 2, правый - 3),
сразу же я проставлю и номера и аминокислотные остатки. Нельзя же решать
задачу, подсмотрев у меня ответ, или я не прав?
.
П: Как выглядят составляющие структуры?
.
K: Альфа-спиральный участок - красного цвета (слева). Бета-спиральный - в
середине. Цикл - справа. В данных РСА красный участок обозначен, как
HELIX от N до M, где N - начало участка из 20 аминокислотных остатков,
а M - конец участка из 20 аминокислотных остатков. M - N = 20.
.
П: Как выглядят эти же структуры РСА?
.
K: Если Вы о третичной структуре, то в виде координат атомов, а если Вы
спрашиваете о данных РСА по вторичной структуре, то в виде слова HELIX
(спираль) или SHEET (бета-слой), TURN (поворот).
.
В моей научной статье Вы можете найти такой пример. Привожу его для наглядности
в текте:
.
N Code Name Name Var Secondary
Kushelev PDB Kushelev Structure
. PDB
18 GGC Gly GLY 1
19 AGT Ser SER 3
20 GGA Gly GLY 2
21 TAC Tyr TYR 1 HELIX
22 GGC Gly GLY 1 HELIX
23 GGT Gly GLY 3 HELIX
24 GCC Ala ALA 1 HELIX
25 GTC Val VAL 1 HELIX
26 GCC Ala ALA 1 HELIX
27 GCG Ala ALA 4 HELIX
28 CTG Leu LEU 4 HELIX
29 CGG Arg ARG 4 HELIX
30 CTG Leu LEU 4 HELIX
31 ACG Thr THR 4 HELIX
32 CAG Gln GLN 1 HELIX
33 GCC Ala ALA 1
34 GGT Gly GLY 3
35 ATC Ile VAL 1
.
На этой иллюстрации из моей научной статьи по моей модели альфа-спираль
начинается с 24 и заканчивается на 33, т.е. в сокращенном виде это будет
записано так:
.
Участок N
24-33
.
По данным Протеин-банка альфа-спираль обнаружена там, где написано слово HELIX,
т.е. по данным PDB альфа-спираль начинается с 21 и заканчивается на 32, т.е. в
сокращенном виде это будет записано так:
21-32.
.
Сравнивая мою модель с данными РСА можно заметить, что они расходятся на три АО
в начале и на один АО в конце. Когда я начинаю беседовать с биологами (как Вы
уже догадались я биологией занимаюсь по случаю, а свою программу CASP.exe
использую в рекламных целях), то первым вопросом обычно бывает: "А почему такое
большое расхождение? Ведь рентген ошибается не больше, чем на один АО?
.
Мой ответ Вы, вероятно, помните из нашей переписки. Я им объясняю, что ошибка
на один ангстрем - это ошибка на один атом, который может принадлежать другому
АО, который может принадлежать другому витку альфа-спирали, поэтому ошибаясь в
пространстве на один атом РСА ошибается может быть на 4 АО вдоль линейной
последовательности. Все специалисты, с которыми я общался на эту тему вынуждены
были признать правомерность моих аргументов, после чего отношение к моей модели
и программе становилось серьезным.
.
Если Вы читали это Л.Б.Меклеру, то он на это вообще не отреагировал, т.к. в
предыдущем письме было написано:
"сдвиг от истинного значения (согласно РСА), не превышает один-два
аминокислотных остатка, обычно в большую сторону."
.
Из этого утверждения я заключаю, что Л.Б.Меклер просто проигнорировал мои
аргументы. А я Вам писал, что слишком хорошее совпадение меня настораживает. Вы
еще ответили тогда:
"...я предвижу резко отрицательное отношение Л.Б.Меклера на Ваше утверждение
"Если у Л.Б. Меклера совпал с рентгенологами лишь один белок, тем лучше для
Л.Б. Меклера. Если много, то плохо, т.к. для меня это означает, что совпали две
ошибочные системы интерпретации"."
.
K: Л.Б.Меклер не отреагировал на эти аргументы, а ведь один маленький факт
может опрокинуть грандиозную теорию...
.
П: Или это неправомерные вопросы?
.
K: Вы можете задавать любые вопросы, однако, заранее ответ на экзамене не дают...
.
Короче, жду, когда Л.Б. пронумерует столбцы на картинке, которую я на всякий
случай (для напоминания актуальности этих вопросов) вкладываю снова в письмо.
.
С уважением к Вам и Л.Б.
Ваш Александр Кушелев
nanoworld@bigfoot.com
 .
.
.
20020121 15.30
П: Александр Юрьевич!
.
Первое, что я сделал - попросил Л.Б.Меклера записать последовательность АО
(согласно PDB) из Вашей статьи. Второе - попросил определить, какие структуры
(альфа-спираль или другие ) он видит в этом фрагменте пептида. Через пять минут
он перезвонил и продиктовал ответ, который воспроизвожу ниже Каждая "скобка"
(соединение от 19 до 23, от 20 до 24 и др.) - это альфа-спирали.
19-23
20-24
21-25
22-26
27-31
28-32
29-33
Мы с Вами видим, что сплошная альфа-спираль от АО № 19 до АО №33 состоит из
отдельных двух участков. В первом (от 19 до 26) четыре перекрывающихся
альфа-спиралей, во втором (от 28 до ЗЗ) три перекрывающихся альфа-спиралей.
Кроме того, видим расхождение с результатом из PDB на два АО вначале и на один
в конце.
.
С уважением
Ваш Павел Червонобродов.
.
K: - Ну, вот и прекрасно! А теперь вернемся к нашим баранам, т.е. продолжим
экзамен, который мы уже вторую неделю не можем завершить.
Пусть Л.Б. напишет номера над столбцами, т.е. определит, какой участок белка
состоит целиком из альфа-спирали, какой из бета-нити, а какой - цикл.
Если у него все получаются одинаковые, то извините, но хотя по литературе можно
поставить "5" за красивые рассказы, но по биологии, в смысле за решение
проблемы фолдинга только "2"...
.
Передайте Л.Б., что я даю ему еще раз хорошенько подумать, можно пересмотреть
те данные по трем участкам, которые он присылал мне раньше, но без ответа на
экзаменационный вопрос зачета быть не может...
.
Пусть Л.Б. заполнит верхнюю строку (участок N), а все остальное (название
остатков, их номера, название белков и организмов) заполню я. Если он номера
проставить не сможет, то грош - цена сегменту "Фолдинг" секретного Ноу-Хау
Л.Б.Меклера. Тогда поговорим о других сегментах Ноу-Хау. Может быть они
работоспособны?
.
См. вложенный файл-картинку:
Ваш А.Кушелев.
nanoworld@bigfoot.com
.
.
.
20020121 15.30
П: Александр Юрьевич!
.
Первое, что я сделал - попросил Л.Б.Меклера записать последовательность АО
(согласно PDB) из Вашей статьи. Второе - попросил определить, какие структуры
(альфа-спираль или другие ) он видит в этом фрагменте пептида. Через пять минут
он перезвонил и продиктовал ответ, который воспроизвожу ниже Каждая "скобка"
(соединение от 19 до 23, от 20 до 24 и др.) - это альфа-спирали.
19-23
20-24
21-25
22-26
27-31
28-32
29-33
Мы с Вами видим, что сплошная альфа-спираль от АО № 19 до АО №33 состоит из
отдельных двух участков. В первом (от 19 до 26) четыре перекрывающихся
альфа-спиралей, во втором (от 28 до ЗЗ) три перекрывающихся альфа-спиралей.
Кроме того, видим расхождение с результатом из PDB на два АО вначале и на один
в конце.
.
С уважением
Ваш Павел Червонобродов.
.
K: - Ну, вот и прекрасно! А теперь вернемся к нашим баранам, т.е. продолжим
экзамен, который мы уже вторую неделю не можем завершить.
Пусть Л.Б. напишет номера над столбцами, т.е. определит, какой участок белка
состоит целиком из альфа-спирали, какой из бета-нити, а какой - цикл.
Если у него все получаются одинаковые, то извините, но хотя по литературе можно
поставить "5" за красивые рассказы, но по биологии, в смысле за решение
проблемы фолдинга только "2"...
.
Передайте Л.Б., что я даю ему еще раз хорошенько подумать, можно пересмотреть
те данные по трем участкам, которые он присылал мне раньше, но без ответа на
экзаменационный вопрос зачета быть не может...
.
Пусть Л.Б. заполнит верхнюю строку (участок N), а все остальное (название
остатков, их номера, название белков и организмов) заполню я. Если он номера
проставить не сможет, то грош - цена сегменту "Фолдинг" секретного Ноу-Хау
Л.Б.Меклера. Тогда поговорим о других сегментах Ноу-Хау. Может быть они
работоспособны?
.
См. вложенный файл-картинку:
Ваш А.Кушелев.
nanoworld@bigfoot.com
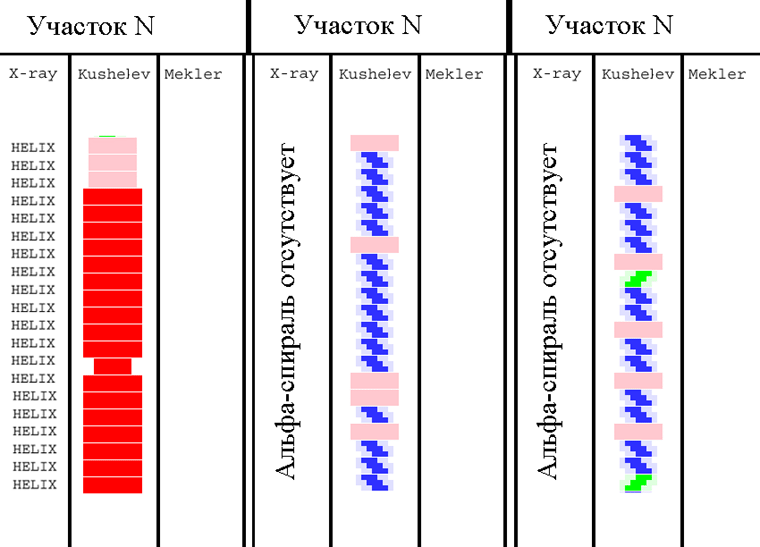 .
.
.
20020121 18.16
П: Александр Юрьевич!
Извините, но я не понимаю в чем смысл Вашего предложения:
"Пусть Л.Б. заполнит верхнюю строку (участок N), а все остальное (название
остатков, их номера, название белков и организмов) заполню я".
Я не понимаю, что означают Ваши элементы разных цветов и конфигураций на трех
столбиках.
.
Как я могу просить Л.Б. Меклера об "экзамене", если не могу изложить ему в чем
его смысл ?
Какую смысловую нагрузку несет заполнение верхней строки?
.
В предыдущем Вашем предложении, на которое Л.Б.Меклером был дан ответ, исодными
данными были последовательности АО. А какие здесь исходные данные?
.
Ваш Павел Червонобродов.
.
K: Мне не трудно повторить:
.
Повтор из моего письма:
Аминокислотная последовательность белка N1:
.
MET-LEU-THR-VAL-GLU-ILE-HIS-ASP-SER-GLN-VAL-SER-VAL-LYS-GLU-ARG-SER-GLY-VAL-
SER-GLN-LYS-SER-GLY-LYS-PRO-TYR-THR-ILE-ARG-GLU-GLN-GLU-ALA-TYR-ILE-ASP-LEU-
GLY-GLY-VAL-TYR-PRO-ALA-LEU-PHE-ASN-PHE-ASN-LEU-GLU-ASP-GLY-GLN-GLN-PRO-TYR-
PRO-ALA-GLY-LYS-TYR-ARG-LEU-HIS-PRO-ALA-SER-PHE-LYS-ILE-ASN-ASN-PHE-GLY-GLN-
VAL-ALA-VAL-GLY-ARG-VAL-LEU-LEU-GLU-SER-VAL-LYS
.
Аминокислотная последовательность белка N2:
.
MET-LYS-VAL-PHE-GLU-ARG-CYS-GLU-LEU-ALA-ARG-THR-LEU-LYS-ARG-LEU-GLY-MET-ASP-
GLY-TYR-ARG-GLY-ILE-SER-LEU-ALA-ASN-TRP-MET-CYS-LEU-ALA-LYS-TRP-GLU-SER-GLY-
TYR-ASN-THR-ARG-ALA-THR-ASN-TYR-ASN-ALA-GLY-ASP-ARG-SER-THR-ASP-TYR-GLY-ILE-
PHE-GLN-ILE-ASN-SER-ARG-TYR-TRP-CYS-ASN-ASP-GLY-LYS-THR-PRO-GLY-ALA-VAL-ASN-
ALA-CYS-HIS-LEU-SER-CYS-SER-ALA-LEU-LEU-GLN-ASP-ASN-ILE-ALA-ASP-ALA-VAL-ALA-
CYS-ALA-LYS-ARG-VAL-VAL-ARG-ASP-PRO-GLN-GLY-ILE-ARG-ALA-TRP-VAL-ALA-TRP-ARG-
ASN-ARG-CYS-GLN-ASN-ARG-ASP-VAL-ARG-GLN-TYR-VAL-GLN-GLY-CYS-GLY-VAL
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-
LEU-SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-
PRO-SER-CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-
ALA-GLN-THR-VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-
ALA-VAL-ALA-PRO-GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-
HIS-ALA-ARG-TYR-LEU-ALA-ARG-CYS-LEU
.
Вы можете сделать модели этих белков целиком, но меня в белке
N1 интересует участок с номерами аминокислотных остатков: 1...21
N2 интересует участок с номерами аминокислотных остатков: 96...117
N3 интересует участок с номерами аминокислотных остатков: 80...100
.
Моя просьба заключается в том, чтобы Л.Б. Меклер эти номера (N1, N2, N3)
вставил в верхнюю строку сводной таблицы. Если он их вставит правильно, то
разговор о работоспособности его Ноу-Хау продолжится. Если нет, то будем
говорить о чем-нибудь другом, т.к. если он не сможет отличить, какой из трех
участков альфа-спираль, какой - бета-нить, а какой - цикл, то я это понимаю
как его полная беспомощность в проблеме фолдинга. На мои данные можете не
обращать внимания. Они полностью совпадают с данными РСА (X-ray) из первого
столбца для каждого участка белка. Стрелками показаны возможные варианты
вставки номера. Если Л.Б. вставит N1 по левой стрелке, т.е. туда, где
альфа-спираль, то это будет означать, что он белок N1 причисляет к
альфа-спиральным.
Если он номер 1 вставит в средний столбец, то это означает, что он первый белок
причислил к бета-нитевым. Может быть я действительно непонятно объясняю?
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
См. подсказку на картинке, которую я вкладываю в это письмо...
.
.
.
20020121 18.16
П: Александр Юрьевич!
Извините, но я не понимаю в чем смысл Вашего предложения:
"Пусть Л.Б. заполнит верхнюю строку (участок N), а все остальное (название
остатков, их номера, название белков и организмов) заполню я".
Я не понимаю, что означают Ваши элементы разных цветов и конфигураций на трех
столбиках.
.
Как я могу просить Л.Б. Меклера об "экзамене", если не могу изложить ему в чем
его смысл ?
Какую смысловую нагрузку несет заполнение верхней строки?
.
В предыдущем Вашем предложении, на которое Л.Б.Меклером был дан ответ, исодными
данными были последовательности АО. А какие здесь исходные данные?
.
Ваш Павел Червонобродов.
.
K: Мне не трудно повторить:
.
Повтор из моего письма:
Аминокислотная последовательность белка N1:
.
MET-LEU-THR-VAL-GLU-ILE-HIS-ASP-SER-GLN-VAL-SER-VAL-LYS-GLU-ARG-SER-GLY-VAL-
SER-GLN-LYS-SER-GLY-LYS-PRO-TYR-THR-ILE-ARG-GLU-GLN-GLU-ALA-TYR-ILE-ASP-LEU-
GLY-GLY-VAL-TYR-PRO-ALA-LEU-PHE-ASN-PHE-ASN-LEU-GLU-ASP-GLY-GLN-GLN-PRO-TYR-
PRO-ALA-GLY-LYS-TYR-ARG-LEU-HIS-PRO-ALA-SER-PHE-LYS-ILE-ASN-ASN-PHE-GLY-GLN-
VAL-ALA-VAL-GLY-ARG-VAL-LEU-LEU-GLU-SER-VAL-LYS
.
Аминокислотная последовательность белка N2:
.
MET-LYS-VAL-PHE-GLU-ARG-CYS-GLU-LEU-ALA-ARG-THR-LEU-LYS-ARG-LEU-GLY-MET-ASP-
GLY-TYR-ARG-GLY-ILE-SER-LEU-ALA-ASN-TRP-MET-CYS-LEU-ALA-LYS-TRP-GLU-SER-GLY-
TYR-ASN-THR-ARG-ALA-THR-ASN-TYR-ASN-ALA-GLY-ASP-ARG-SER-THR-ASP-TYR-GLY-ILE-
PHE-GLN-ILE-ASN-SER-ARG-TYR-TRP-CYS-ASN-ASP-GLY-LYS-THR-PRO-GLY-ALA-VAL-ASN-
ALA-CYS-HIS-LEU-SER-CYS-SER-ALA-LEU-LEU-GLN-ASP-ASN-ILE-ALA-ASP-ALA-VAL-ALA-
CYS-ALA-LYS-ARG-VAL-VAL-ARG-ASP-PRO-GLN-GLY-ILE-ARG-ALA-TRP-VAL-ALA-TRP-ARG-
ASN-ARG-CYS-GLN-ASN-ARG-ASP-VAL-ARG-GLN-TYR-VAL-GLN-GLY-CYS-GLY-VAL
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-
LEU-SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-
PRO-SER-CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-
ALA-GLN-THR-VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-
ALA-VAL-ALA-PRO-GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-
HIS-ALA-ARG-TYR-LEU-ALA-ARG-CYS-LEU
.
Вы можете сделать модели этих белков целиком, но меня в белке
N1 интересует участок с номерами аминокислотных остатков: 1...21
N2 интересует участок с номерами аминокислотных остатков: 96...117
N3 интересует участок с номерами аминокислотных остатков: 80...100
.
Моя просьба заключается в том, чтобы Л.Б. Меклер эти номера (N1, N2, N3)
вставил в верхнюю строку сводной таблицы. Если он их вставит правильно, то
разговор о работоспособности его Ноу-Хау продолжится. Если нет, то будем
говорить о чем-нибудь другом, т.к. если он не сможет отличить, какой из трех
участков альфа-спираль, какой - бета-нить, а какой - цикл, то я это понимаю
как его полная беспомощность в проблеме фолдинга. На мои данные можете не
обращать внимания. Они полностью совпадают с данными РСА (X-ray) из первого
столбца для каждого участка белка. Стрелками показаны возможные варианты
вставки номера. Если Л.Б. вставит N1 по левой стрелке, т.е. туда, где
альфа-спираль, то это будет означать, что он белок N1 причисляет к
альфа-спиральным.
Если он номер 1 вставит в средний столбец, то это означает, что он первый белок
причислил к бета-нитевым. Может быть я действительно непонятно объясняю?
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
См. подсказку на картинке, которую я вкладываю в это письмо...
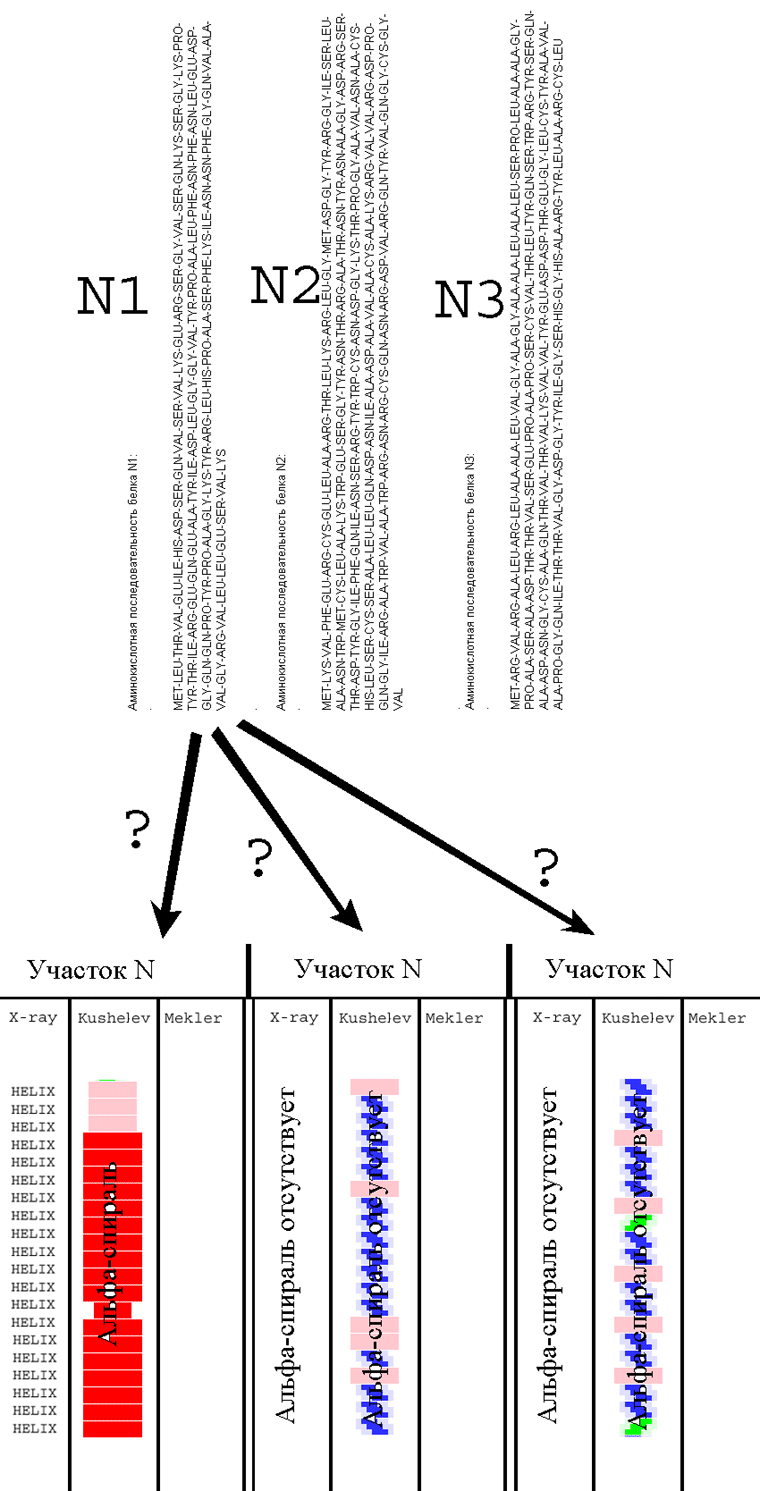 .
.
.
20020121 19.00 Дополнительное объяснение для Л.Б. Меклера
П: Александр Юрьевич!
Извините, но я не понимаю в чем смысл Вашего предложения...
.
K: Вы прислали данные Л.Б.Меклера, которые в сокращенном виде выглядят так:
.
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Мое предложение: Пусть Л.Б.Меклер скажет, какой из этих трех участков
представляет собой непрерывную альфа-спираль. По данным РСА один из трех
участков - непрерывная альфа-спираль. Если угадает, то разговор о фолдинге
продолжается.
.
С уважением,
Ваш Кушелев.
nanoworld@bigfoot.com
.
.
.
20020121 20.00 Тема: упрощение вопроса
K: Данные Л.Б. Меклера:
.
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Данные РСА:
.
Nx
альфа-спираль продолжается все 20 АО.
.
Ny
альфа-спиралей нет.
.
Nz
альфа-спралей нет.
.
От Л.Б. Меклера требуется написать:
.
x =
y =
z =
.
Например, x = 1, y = 2, z = 3.
С уважением,
Ваш Кушелев
nanoworld@bigfoot.com
.
P/S
Надеюсь, что одно из трех последних писем Вам удастся понять.
.
.
.
20020121 20.12 Тема: О научных статьях А.Кушелева
П: Уважаемый Александр Юрьевич!
.
Спасибо за информацию. Интересно! Насколько я понял, это публикация в журнале,
сайт которого, если он есть, хотелось бы посетить. Есть адрес?
А если нет, то какая организация издает и каким тиражом?
Хотел бы познакомиться с другими Вашими научными публикациями. Можете ли
ознакомить со списком?
Ваш Павел Червонобродов.
.
K: Обложку с индексом журнала вкладываю в письмо, а электронного адреса сказать
не могу, т.к. бумажный вариант журнала не сохранился. Я думаю, что Вы сможете
найти его по индексу либо в Internet, либо в библиотеке.
.
На счет организации я не интересовался. Тираж я тоже не знаю. Я думаю, что Вы
сможете это узнать, если доберетесь до библиотеки.
.
Мои научные статьи можно посмотреть на сайте по адресу:
http://ftp.decsy.ru/nanoworld/public/index.htm
.
Вставляю этот список в текст этого письма:
.
Статьи / Articles
19970905 Формы, механизмы, энергия наномира
20000120 Микроволновый экологичный источник энергии (опубликовано)
20000131 Построение масштабной модели структуры белка (в печати)
20000207 Микроволновый двигатель (опубликовано)
20000329 Шестеренчатая передача Кушелева
20000331 Разработка экологически чистых микроволновых источников энергии
20000410 Лазерный бронежилет
20000411 Новые виды резонаторов
20000509 Построение масштабной модели структуры белка (реконструкция)
20000526 Формограмма
20010111 Высокие технологии инопланетных пришельцев
20010127 Шестерни с двумя степенями свободы и новые виды передач
20010517 Двигатель летающих тарелок
20010931 Актуальные проблемы современной науки (опубликовано)
20011031 Расчет силы тяги в крестодвижителе
.
Вы можете посмотреть все эти статьи, зайдя на мой сайт по адресу:
http://ftp.decsy.ru/nanoworld/index.htm
.
Кстати, а Вам Роза Идлис не показывала мои лазерные диски? Она перестала писать
как раз после того, как ее отец заехал ко мне в гости и взял для нее пару
лазерных дисков. Вероятно, она их в данный момент изучает...
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
.
20020121 19.00 Дополнительное объяснение для Л.Б. Меклера
П: Александр Юрьевич!
Извините, но я не понимаю в чем смысл Вашего предложения...
.
K: Вы прислали данные Л.Б.Меклера, которые в сокращенном виде выглядят так:
.
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Мое предложение: Пусть Л.Б.Меклер скажет, какой из этих трех участков
представляет собой непрерывную альфа-спираль. По данным РСА один из трех
участков - непрерывная альфа-спираль. Если угадает, то разговор о фолдинге
продолжается.
.
С уважением,
Ваш Кушелев.
nanoworld@bigfoot.com
.
.
.
20020121 20.00 Тема: упрощение вопроса
K: Данные Л.Б. Меклера:
.
N1
2-5
4-8
7-11
10-14
21-25
.
N2
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
.
N3
77-81
80-84
81-85
86-90
91-94
95-98
96-99
97-101
.
Данные РСА:
.
Nx
альфа-спираль продолжается все 20 АО.
.
Ny
альфа-спиралей нет.
.
Nz
альфа-спралей нет.
.
От Л.Б. Меклера требуется написать:
.
x =
y =
z =
.
Например, x = 1, y = 2, z = 3.
С уважением,
Ваш Кушелев
nanoworld@bigfoot.com
.
P/S
Надеюсь, что одно из трех последних писем Вам удастся понять.
.
.
.
20020121 20.12 Тема: О научных статьях А.Кушелева
П: Уважаемый Александр Юрьевич!
.
Спасибо за информацию. Интересно! Насколько я понял, это публикация в журнале,
сайт которого, если он есть, хотелось бы посетить. Есть адрес?
А если нет, то какая организация издает и каким тиражом?
Хотел бы познакомиться с другими Вашими научными публикациями. Можете ли
ознакомить со списком?
Ваш Павел Червонобродов.
.
K: Обложку с индексом журнала вкладываю в письмо, а электронного адреса сказать
не могу, т.к. бумажный вариант журнала не сохранился. Я думаю, что Вы сможете
найти его по индексу либо в Internet, либо в библиотеке.
.
На счет организации я не интересовался. Тираж я тоже не знаю. Я думаю, что Вы
сможете это узнать, если доберетесь до библиотеки.
.
Мои научные статьи можно посмотреть на сайте по адресу:
http://ftp.decsy.ru/nanoworld/public/index.htm
.
Вставляю этот список в текст этого письма:
.
Статьи / Articles
19970905 Формы, механизмы, энергия наномира
20000120 Микроволновый экологичный источник энергии (опубликовано)
20000131 Построение масштабной модели структуры белка (в печати)
20000207 Микроволновый двигатель (опубликовано)
20000329 Шестеренчатая передача Кушелева
20000331 Разработка экологически чистых микроволновых источников энергии
20000410 Лазерный бронежилет
20000411 Новые виды резонаторов
20000509 Построение масштабной модели структуры белка (реконструкция)
20000526 Формограмма
20010111 Высокие технологии инопланетных пришельцев
20010127 Шестерни с двумя степенями свободы и новые виды передач
20010517 Двигатель летающих тарелок
20010931 Актуальные проблемы современной науки (опубликовано)
20011031 Расчет силы тяги в крестодвижителе
.
Вы можете посмотреть все эти статьи, зайдя на мой сайт по адресу:
http://ftp.decsy.ru/nanoworld/index.htm
.
Кстати, а Вам Роза Идлис не показывала мои лазерные диски? Она перестала писать
как раз после того, как ее отец заехал ко мне в гости и взял для нее пару
лазерных дисков. Вероятно, она их в данный момент изучает...
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
 .
.
.
20020121 20.30
П: Александр Юрьевич!
Теперь я понял, что речь идет о трех ранее предложенных Вами пептидах, по
которым решение Л.Б. Меклера я посылал Вам, но Вы пожелали вернуться к ним в
предлагаемой Вами форме. Так?
.
K: - Так.
.
П: Мне нет надобности обращаться к Л.Б. Меклеру, поскольку ответы на Ваши
вопросы имеются из той ранее посланной Вам информации.
.
K: - Нет. Ответа на мой вопрос, какой из трех участков представляет собой
непрерывную альфа-спираль длиной 20 АО у меня до сих пор нет.
.
П: Мои действия.
1. Сверяю аминокислотные остатки. Да, это те же и в той же последовательности.
2. Проставляю номера по порядку для белка
№1 от 1 до 88
№2 от 1 до 117
№3 от 1 до 104
.
3. Проставляю в верхней строке №№ участков "от" и "до", по которым Л.Б.Меклер
определял интересующие Вас вторичные структуры.
Вот они;
Для белка
№1 1-25
№2 91-120
№3 76-104
.
4. Обращаюсь к ранее посланному Вам результату.
Для белка №1 непрерывная альфа - спираль, указанная Л.Б.Меклером,
охватывает АО от №2 до № 16, далее от № 20 до №25
Л.Б.Меклер указал наличие бета - поворота. Обращаю Ваше внимание, что
внутри непрерывной альфа-спирали есть четыре альфа - спирали, перекрыващие
друг друга, а внутри бета поворота есть два, из которых один (20 - 24)
перекрывает другой (21-25).
.
Ваш Павел Червонобродов.
.
K: Меня пока не интересует то, что ответил Л.Б. Меклер, т.к. я не хочу лезть в
дебри его компонент связности. Я специально упростил вопрос. Формулирую его еще
раз: Пусть Л.Б.Меклер выберет один из трех ответов:
.
A) Участок белка N1 является непрерывной альфа-спиралью.
B) Участок белка N1 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N1 является циклом
.
Других вариантов в результатах РСА нет.
.
После ответа на этот вопрос пусть Л.Б. выберет еще один ответ из трех:
.
A) Участок белка N2 является непрерывной альфа-спиралью.
B) Участок белка N2 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N2 является циклом
.
После ответа на этот вопрос пусть Л.Б. выберет еще один ответ из трех:
.
A) Участок белка N3 является непрерывной альфа-спиралью.
B) Участок белка N3 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N3 является циклом
.
Если он выберет правильные ответы, то мы продолжим дискуссию о фолдинге. Если
ошибется, промолчит или начнет рассказывать о своих достижениях и наградах, то
мы с Вами можем продолжать дискуссию, но уже не о фолдинге, т.к. я буду считать,
что задачу фолдинга Л.Б. решить не смог даже в первом приближении.
.
С уважением к Вам и Л.Б.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020121 22.09.
П: Уважаемый Александр Юрьевич!
.
Начать хочу с фактов в моем представлении - не биолога. Для меня это важно в
свете длительного спора с близкими мне людьми, которые говорят: "Если бы Меклер
владел тем, о чем заявляет, то это бы стало достоянием мира, подобно тому как
устами руководителей США и Великобритании было на весь мир объявлено о
расшифровке ДНК Крейгом Винтером и другими учеными, участниками программы
"Геном человека" ".
.
Спор идет и на уровне профессионалов. Вот выдержка из статьи Олега Котова
"Секретные алгоритмы стоят вне науки", опубликованной в газете "Коммерсант" в
связи с семинаром Биохимического общества РАН, посвященном обсуждению теории
Л.Б.Меклера. "... в результате обсуждения мнения о работе разделились: от
восторженных -А.А.Замятнина, В.З.Плетнева, М.А. Молкульского, до взвешенных
- В.Т.Иванова, Д.Г.Кнорре, Л. А. Блюменфельда, Б.К.Вайнштейна и, наконец, до
отрицательных -М.В. Волькенштейна, В.И. Иванова и В.Г. Дашевского. И в
настоящее время соображения, подобные предложенным Л.Б.Меклером, находятся в
русле активной дискуссии. Работы Меклера - Идлис цитируются".
.
Мне хотелось бы, чтобы наш разговор был понятен для не биологов. Тогда он будет,
я надеюсь, интересен, так как касается актуальной научной проблемы,
затрагивающей интересы обеспечения здоровья людей, и не только.
.
Я думаю, что состояние того решения, которое имеет Л.Б.Меклер по проблеме
фолдинга относится к варианту №2, который Вы опредилили; "Есть товар, есть
начальный капитал. Проводится рекламная кампания, и товар начинает продаваться.
Есть справки или нет, для хорошего товара большого значения не имеет, т.к. он
не вызовет нареканий"
.
О том, что НОУ-ХАУ Л.Б. Меклера - это способ с помощью компьютерной программы
получить хороший товар, понимают те, кто готовы щедро финансировать ее
изготовление.
.
На сегодняшний день Л.Б.Меклер может согласиться только с тем инвестором,
который в условиях договора с ним, обеспечит использование компьютерной
программы реализации процесса фолдинга только на благо людей. И пока в этом
состоит загвоздка, которую - есть на то основание - удасться преодолеть.
.
Ваш Павел Червонобродов
.
K: Если Л.Б. отгадает типы тех самых трех участков, о которых мы беседуем уже
вторую неделю, то эту загвоздку мы будем решать вместе.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020122 08.00
K: Здравствуйте, уважаемый Павел Леонович!
Попытайтесь сосредоточиться и понять меня.
1. Л.Б. Меклер передал мне данные по трем участкам белков N1, N2, N3.
2. В N1, N2, N3 по Меклеру содержатся альфа-спирали.
3. Один из белков в этой экзаменационной задаче - фиброин (классическая
бета-структура, в которой нет ни одной альфа-спирали).
.
Если Л.Б. будет настаивать, что в фиброине есть альфа-спирали, то это то же
самое, что настаивать на том, что в конструкции велосипеда есть дизельный
двигатель от самосвала.
.
У Л.Б. осталось два варианта: Либо пересмотреть свои данные и угадать, какой из
трех белков - фиброин, либо о фолдинге Меклера не может быть и речи.
.
Если в вопросе о наличии альфа-спиралей в бета-фиброине его будут поддерживать
профессора и академики, то пусть они занимаются проблемой фолдинга, но без
моего участия.
.
Таким образом, продолжать разговор о фолдинге Л.Б.Меклера мы сможем только при
условии пересмотра Л.Б.Меклером своих данных (N1,N2,N3) и угадыванием, какой из
этих участков принадлежит фиброину.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020122 23.16 - 00.29 Тема: Последний шанс для фолдинга Л.Б. Меклера
П: Уважаемый Александр Юрьевич!
.
Фиброин - это третий из трех пептидов (участков - в Вашем обозначении).
.
К: Я на память не помню, сейчас буду смотреть, но можно начать с комплимента
Лазарю Борисовичу за смелость попытаться отгадать одну из трех структур. При
этом вероятность удачи всего 1/3.
.
Я правильно понимаю, что Лазарь Борисович имеет в виду, что фиброину
соответствует структура N3, аминокислотная последовательность которой:
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-
LEU-SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-
PRO-SER-CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-
ALA-GLN-THR-VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-
ALA-VAL-ALA-PRO-GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-
HIS-ALA-ARG-TYR-LEU-ALA-ARG-CYS-LEU
.
Чтобы не ошибиться в спешке я хочу, чтобы Лазарь Борисович проверил, что это -
третий из трех пептидов. Если Л.Б. подтверждает, что это последовательность
фиброина, то я присылаю структуру этого белка, его полное название и свою
модель тоже.
.
П: Вы вправе спросить, как это может быть, ведь известно, что фиброин - это
классическая бета-структура, в которой нет ни одной альфа-спирали, тогда как в
посланном мной Вам ранее сообщении показывалось, что третий пептид состоит из
восьми альфа-спиралей.
.
(Тут я должен ивиниться, так как обнаружил свою ошибку, а именно - пропустил
П - К связь 89 -93 и, следовательно, должен был показывать не восемь, а девять
П-К связей, или иначе - три смешанных спиральных фрагмента, каждый из которых
формируется тремя П-К связями в шаге три или четыре, и поэтому все три данных
фрагмента этого пептида №3 лишь частично устойчивы, ибо полностью устойчив
фрагмент алфа-спиралей, сформированный, как минимум, четырьмя перекрывающимися
П - К связями).
.
K: Это мы обсудим после проверки. Я еще сам не знаю, угадали Вы или нет. Пока
Вы будете проверять, правильно ли я Вас понял, я посмотрю, "кто" у нас пептид N3.
.
П: Теперь отвечаю на вопрос, с которого начал. Дело в том, что сообщая мне
результаты, Л.Б. Меклер предупредил, что в зависимости от количества П-К связей
и их суммарной энергии может быть переход из структуры альфа-спирали в
бета-структуру. Я этому не придал значения. А теперь оказалось, что как раз
третий пептид - тому блистательный пример, так как в нем одиннадцать подряд П-К
связей без единого пропуска - это физическая основа прочности фиброина шелка.
.
K: Это мы тоже обсудим после окончательной проверки.
.
П: Ниже привожу иллюстрацию сказанному, позволяющую понять механизм перехода из
одной структуры в другую (по ходу формирования данной структуры в растворе -
это было сказано мне изначально)
.
Пептид ( участок) №1
а/ то, что я посылал
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25
M L T V E I H D S Q V S V L E R S G V S Q K S G K
I______ I
эта скобка символизирует П-К связь между двумя АО - 2 и 5 (альфа 3/10)
Скобки 4-8 7-11 10-14 12-16 это пять П-К связей непрерывной альфа-спирали
Скобки 20-24 21-25 это два бета-поворота
б/ то, что получилось после перехода в бета-структуру
M L T V E I H D S Q V
I \ \ / I I S здесь образовалось шесть П-К связей
K G S K Q S V G S R E L V
Пептид (участок) № 3
а/ то, что я посылал
76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104
Y A V A P G Q I T T V G D G Y I G S H G H A R Y L A R C L
I___________I
эта скобка символизирует П-К связь между двумя АО 77 и 81 (альфа 4/10 )
скобки 77-81 80-84 81-85 (три перекрытия) 86-90 89-93 91-94 (еще три перекрытия)
95-98 96-99 97-101 (еще три перекрытия) - итого девять П-К связей альфа-спиралей.
Три фрагмента по три, поэтому неустойчивые (в спектрах кругового дихроизма будут выглядеть
как фрагмент 75% альфаспирализации).
б/ то, что получилось после перехода в бета-структуру
Y A V A P G Q I T T V G D G Y
I I I I I I I I I I I I
L C R A L Y R A H G H S G
Обращает на себя внимание тот знаменательный факт, что данная бета-структура
сформирована одиннадцатью рядом стоящими П-К связями без единого пропуска -
структурно-генетическое выражение удивительной прочности фиброина.
.
Из показанного видно, что ответ на вопрос - будет ли тот или иной фрагмент
бирпрлипептида альфа-спиралью, совокупностью бета-изгибов или бета-структурой
достигается построением соответствующих моделей согласно П-К коду ОСГК, и
выбором из них той модели, которая содержит максимальное число П-К связей, а
при равенстве числа связей выбором энергетически более устойчивой модели, а при
равной устойчивости - большим числом энергетически более сильных П-К связей.
.
Итак, результат экзамена - четыре верно построенных моделей (включая из Вашей
статьи). Теперь Вы можете сказать то, что собирались - "Л.Б.Меклер - Вы бог" ?
.
Ваш Павел Червонобродов.
.
K: Ну, Вы крут, Павел Леонович! После Вашего утверждения, что в результате
экзамена верно решено 4 задачи из 3 (!) я сразу вспомнил студенческую
самодеятельность. Там на сцену выходил "строгий профессор" и говорил:
"Та-акс... За 14 секунд мы, точнее Вы должны решить 10 задач из 7..."
.
Вы не видели эту сценку?
.
Давайте договоримся, что в экзаменационную задачу мы не будем включать ничего
постороннего. А то может получиться как с соавторами: сначала к автору
присоединяется куча соавторов, потом автора отодвигают в конец списка, а на
третьей стадии список укорачивают.
.
Мне не хотелось бы, чтобы с нашей экзаменационной задачей случилась аналогичная
история. Участок белка из моей статьи не входит в нашу экзаменационную задачу.
Какой смысл давать на экзамене вопрос в комплекте с ответом? Если мне не
изменяет память, то я привел пример из своей статьи, отвечая на Ваш вопрос:
Вопрос Павла Леоновича: П: Как выглядят составляющие структуры?
.
Ответ Кушелева: Альфа-спиральный участок - красного цвета (слева).
Бета-спиральный - в середине. Цикл - справа. В данных РСА красный участок
обозначен, как HELIX от N до M, где N - начало участка из 20 аминокислотных
остатков, а M - конец участка из 20 аминокислотных остатков. M - N = 20.
.
Вопрос Павла Леоновича: Как выглядят эти же структуры РСА?
.
Ответ Кушелева: Если Вы о третичной структуре, то в виде координат атомов, а
если Вы спрашиваете о данных РСА по вторичной структуре, то в виде слова
HELIX (спираль) или SHEET (бета-слой), TURN (поворот).
.
В моей научной статье Вы можете найти такой пример. Привожу его для наглядности
в текте: ...
.
Конец цитаты.
.
Итак, это был пример, а вовсе не часть экзамена. Не будем включать этот пример
в наш экзамен, чтобы не получилось как с автором, которого сократили из общего
списка соавторов.
.
Теперь давайте разберемся с Вашим утверждением: "Итак, результат экзамена -
четыре верно построенных моделей (включая из Вашей статьи)."
.
Из этих 4 мы сразу вычтем "включая из статьи", т.к. этот пример в экзамен не входит.
Из оставшихся 3 я пока что вижу одно утверждение, что третий пептид - фиброин.
Если окажется, что Л.Б. угадал, то должно остаться еще 2 правильных ответа.
.
Рассматривая структуру пептида N1 я не понимаю, к какому классу пептидов ее
причислил Л.Б. Он пишет, что пептид N1 переходит в бета-структуру. Что это
значит? Пептид N1 - тоже является бета-нитью? Или он образует цикл? А может
быть он переходит обратно в альфа-спираль?
.
Пусть Л.Б. сделает выбор:
A) Пептид N1 - это альфа-спираль без включений бета-структуры
B) Пептид N1 - это бета-нить без включения альфа-спиралей
C) Пептид N1 - это бета-нить, в которой последний пептид химически связан с
первым (без включения альфа-спиралей)
.
Если Л.Б. сделает окончательный выбор для пептида N1, то его ответ будет принят
и рассмотрен. Это будет второй ответ из 3.
.
Ну и третий ответ - это выбор:
.
A) Пептид N2 - это альфа-спираль без включений бета-структуры
B) Пептид N2 - это бета-нить без включения альфа-спиралей
C) Пептид N2 - это бета-нить, в которой последний пептид химически связан с
первым (без включения альфа-спиралей)
.
Если Л.Б. сделает окончательный выбор для пептида N2, то его ответ будет принят
и рассмотрен. Это будет третий ответ из 3.
.
На самом деле, если два белка из трех определены, то третий определяется
однозначно. Мне этот третий ответ нужен для "контроля на четность".
.
Таким образом вероятность угадать три белка из трех составляет 1/6, т.е.
похожа на вероятность выстрела в "Русской рулетке".
.
Итак, я жду обещанных 3 правильных ответа. (4 из 3 - это согласитесь, будет уже
перебор)
.
С уважением к Вам и Л.Б.
Еще раз отдаю честь Лазарю Борисовичу за смелость.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020123 16.00
П: Уважаемый Александр Юрьевич!
.
Согласен с Вами - пример из Вашей статьи не будем включать в "экзамен". Это для
меня было подтверждением умения Л.Б. Меклера предсказывать вторичные структуры.
И кроме того, было интересно отметиь, что Ваш и его результаты ложатся в рамки
высказанного Вами ранее отношения к подобным предсказаниям.
.
1. Подтверждаю, что пептид №3 взят из белка, о котором Вы спрашиваете.
.
2. Отвечаю на Ваш вопрос:
"Рассматривая структуру пептида N1 я не понимаю, к какому классу пептидов ее
причислил Л.Б. Он пишет, что пептид N1 переходит в бета-структуру. Что это
значит? Пептид N1 - тоже является бета-нитью? Или он образует цикл? А может
быть он переходит обратно в альфа-спираль?"
.
В свете пояснений о критериях устойчивости и выборе из нескольких состояний
наиболее устойчивой структуры, я думаю, что шесть разорванных П - К связей
пептида №1 в состоянии бета-структуры менее устойчивы, чем пять перекрывающих
друг друга П - К связей (см. ниже "скобки" 2 - 5, 4 - 8, 7 - 11, 10 - 14,
12-16), образующих непрерывную альфа-спираль от АО №2 до АО № 16, а в интервале
от АО №20 до АО 25 находятся два перекрывающих друг друга бета-поворота.
Следовательно, этот пептид смешанный.
.
K: -Мне нравится ход Ваших мыслей, поэтому предлагаю принять участие в виде
отдельного экзаменуемого.
.
Я правильно понял, что Вы (Павел Леонович) пептид N1 причисляете к:
.
A) Участок белка N1 является непрерывной альфа-спиралью.
B) Участок белка N1 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N1 является циклом
.
Назовите букву, т.к. любой другой ответ будет расценен как неверный.
.
А еще я хотел бы знать, как считает лично Л.Б. (мне интересно, кто из Вас лучше
предскажет. Если Л.Б., то фармацевтические фирмы захотят заключить договор с
ним, а если Вы, то с Вами).
.
П: 3. По поводу пептида №2 попробуйте, используя ранее посланный ответ
Л.Б.Меклера по этому пептиду и пояснения о компонентах связности и П-К коде не
"одгадать", а научно предсказать (именно это делает Л.Б.Меклер) устойчивую
структуру, используя описание П-К кода в имеющейся у Вас статье Л.Б.Меклера и
Р.Г.Идлис ("Природа", №5, 1993), Если не захотите провести такой экперимент, то
ответ, разумеется, за мной.
.
Ваш Павел Червонобродов.
.
K: - На счет пептида N2 Вы делаете мне довольно соблазнительное предложение,
т.к. во-первых я знаю правильный ответ, во-вторых, если Вы пришлете данные по
пептиду N1 (можно свои, но данные Л.Б. Меклера обязательно, иначе он может
досрочно выбыть из участников экзамена за "прогулы"), то методом исключения
можно написать данные для пептида N2.
.
Но я бы предпочел закончить с экзаменом Л.Б.Меклера. Если его секретное Ноу-Хау
сработает, согласно Вашему выражению:
"...попробуйте... не "отгадать", а научно предсказать (именно это делает
Л.Б.Меклер)" (конец цитаты),
то я с удовольствием буду разбираться с технологией, если у меня хватит на нее
денег...
.
Итак, я жду выбор Л.Б. Меклера и, если Вы тоже хотите принять участие, как
независимый специалист, то отдельно Ваш быбор для пептидов N1, N2, N3.
.
Короче, заполняйте таблицу:
. Меклер Червонобродов РСА
N1 ? ? ?
N2 ? ? ?
N3 B ? ?
.
Пока что в этой таблице, как мы с Вами можем видеть, только одна конкретная
буква, означающая, что Л.Б. считает, что пептид N3 соответсвует строке:
B) Участок белка N3 является бета-нитью без включения альфа-спиральных участков.
.
Я жду еще две буквы от Л.Б. Меклера, и если хотите, то три буквы от Вас.
Последние три буквы (столбец РСА) заполняются сразу после заполнения столбца
Л.Б. Меклера. Ваш столбец Вы заполняете по желанию, т.е. хотите - заполняйте,
хотите - нет.
.
Передайте, пожалуйста Л.Б. Меклеру, что его "прогулы", т.е. отсутствие данных
по пептиду N1 и N2 в очередном письме, расцениваются как неуважительное
отношение к экзамену. Я, как Вы уже убедились, "экзаменатор терпеливый", но что
подумают читатели энциклопедии Наномир? Скажут: "Что это, он так тянет с
ответом? Ай-яй-яй..."
.
С уважением и надеждой на скорейший ответ Л.Б. Меклера (заполнение таблицы:
N1-?
N2-?
N3-B,
которая заполнена уже на одну треть (что все-таки радует)).
.
Ваш Кушелев
nanoworld@bigfoot.com
.
.
.
20020123 20.44
.
П: Уважаемый Александр Юрьевич!
.
1.На Ваш вопрос:
.
"Я правильно понял, что Вы (Павел Леонович) пептид N1 причисляете к:
.
A) Участок белка N1 является непрерывной альфа-спиралью.
B) Участок белка N1 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N1 является циклом"
.
я уже дал ответ. Если хотите его увидеть ответ в форме букв, то отвечаю -
смесь "А" и "В".
.
K: Если Вы внимательно читали мое письмо, то, вероятно заметили фразу:
Назовите букву, т.к. любой другой ответ будет расценен как неверный.
.
Заметьте, букву, а не смесь, комбинацию или конгломерат. Либо Вы выбираете одну
из трех букв, либо Ваш ответ будет засчитан как неверный. Верный ответ лишь
один из трех. Либо A, либо B, либо C. Прежде чем отсылать Ваш ответ проверьте,
совпадает ли он с предлагаемыми вариантами. Если не совпадает, то Вы заведомо
посылаете неправильный ответ. Даю Вам еще одну попытку исправиться.
.
П: 2. Ваше высказывание:
.
"А еще я хотел бы знать, как считает лично Л.Б. (мне интересно, кто из Вас
лучше предскажет. Если Л.Б., то фармацевтические фирмы захотят заключить
договор с ним, а если Вы, то с Вами)"
.
я воспринимаю как шутку, ибо мои "предсказания" - это лишь попытка
использовать то, что я услышал от Л.Б.Меклера. И уж конечно смешно говорить,
что со мной "фармацевтические фирмы захотят заключить договор".
.
К: Если Вы пытаетесь использовать то, что услышали от Л.Б. Меклера, то прежде,
чем посылать его предполагаемый ответ, сообщите Меклеру, что в случае Вашей
ошибки он лишится потенциальных заказчиков. Уточните у него, подтверждает он
Ваш предполагаемый ответ или нет (если Вас интересует результат экзамена).
.
П: 3. Предлагая Вам ответить на вопрос о пептиде № 2, я имел в виду
воспроизведение процедуры выбора устойчивой конфигурации из возможных на основе
указанных Л.Б.Меклером критериев.
Коль Вы не готовы включиться в это действо, то сообщаю свой ответ - "А".
.
Итак, заполняю Вашу таблицу
.
Меклер Червонобродов РСА
N1 ? А и В ?
N2 ? А ?
N3 B В ?
.
Что касается Л.Б.Меклера, он уже выдержал серьезные экзамены (о них я Вам
сообщал). Сейчас он занят специальным "самоэкзаменом", в ходе которого
придирчиво проверяет свое Ноу-Хау и я считаю для себя не этичным ставить перед
ним вопросы в порядке экзамена.
Если мои ответы окажутся правильными, то рассматривайте их как его ответы.
.
Ваш Павел Червонобродов.
.
K: Уважаемый Павел Леонович!
.
1. Что касается заполнения таблицы, то если Вы прочитали мое письмо, то там
было написано:
.
Последние три буквы (столбец РСА) заполняются сразу после заполнения столбца
Л.Б. Меклера.
Ваш столбец Вы заполняете по желанию, т.е. хотите - заполняйте, хотите - нет.
.
Я вижу, что Вы изъявили желание принять участие в этом экзамене, примите мои
поздравления! Однако, Вы сходу обогнали Л.Б. Меклера по "посещаемости" вдвое,
т.е. Ваши два из трех ответа принимаются к рассмотрению. Столбец данных РСА я
заполню сразу, как только Л.Б. лично примет участие (после серьезных экзаменов)
в моем несерьезном экзамене. Дейстительно, что это за экзамен, где требуется
дать ответ, состоящий всего из трех букв?
.
Мне жена как раз говорила в прошлый раз: "Что за ерундой ты занимаешься?
Сколько можно одинаковых вопросов по почте посылать?". Вы (П.Л. и моя жена)
убедили меня, что экзамен действительно серьезным назвать трудно, поэтому у
меня возникла классная идея:
.
Тут у меня мимо экрана компьютера постоянно проползает любопытная дочка. Ей на
днях исполнилось уже 8 месяцев.
.
Я и подумал: если все вокруг считают этот экзамен несерьезным, то почему бы и
ей не поучаствовать?
.
Она уже умеет говорить "Да, нет", показывать пальцем на то, что ей больше
нравится. Я ей тоже задам по каждому из трех белков по три вопроса и посмотрю,
на какую из трех цветных картинок она покажет. Чем черт не шутит, а вдруг
угадает?!
.
Итак, в нашем несерьезном конкурсе уже 3 участника, не считая РСА:
.
Меклер Червонобродов Люба РСА
N1 ? ? ? ?
N2 ? A ? ?
N3 B B ? ?
.
Смотрите-ка! Таблица постепенно заполняется. Пока лидирует П.Л.
.
Жаль, что наш несерьезный экзамен проходит так медленно, как говориться в час
по чайной ложке. Но конкурс CASP, в котором участвовала наша лаборатория
Наномир, длился еще дольше (около двух месяцев). Каждую неделю нам присылали
пару-тройку белков и мы должны были в течение 24 часов прислать ответ. Он сразу
выставлялся на сервер. Наши ответы продержались после окончания конкурса всего
неделю, а потом их стерли, однако если они Вас заинтересуют, то Вы их можете
посмотреть на нашем сервере в разделе "Переписка". Их можно найти по ключевому
слову "CASP".
.
Но, вернемся к нашей таблице. Условие экзамена, что столбец РСА заполняется
после столбца Меклера остается в силе. Если Л.Б. не хочет продолжать участие в
конкурсе, то пусть скажет об этом лично. Ведь насильно никто не заставляет...
.
Правда, для меня это будет означать, что он не в состоянии определить структуру
остальных пептидов даже по своей собственной оценке.
.
В этом случае мы можем дальше продолжить экзамен с оставшимися двумя
участниками. В конце концов одному из участников могут достаться не только
слава и почет, но и заказы фармацевтических фирм.
.
Если раньше я Вам писал, что мы не занимаемся переговорами с фармацевтическими
фирмами, то пока шел экзамен, мне прислали 2 письма из Китая и Гон-Конга. Я не
уверен, что это - фармацевтические фирмы, но их интересуют как раз белки.
.
Я бы на Вашем месте предоставил Л.Б. Меклеру решать судьбу его Ноу-Хау ему
самому, а то ведь обидится на Вас, если Вы будете решать за него.
.
С уважением
к серьезным участникам
несерьезного экзамена.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020124 17.00
Александр Юрьевич!
.
Справимся ли мы с задачей сделать наш разговор деловым, серьезным, понятным и
интересным для широкого круга читателей Вашего сайта?
.
Ваш пассаж с включением в "отгадывание" Вашей дочурки подрывает на это надежду.
.
K: Начнем с того, что на мой вопрос о причине "прогуливания нашего экзамена"
господином Меклером Вы заявили, что он уже прошел очень серьезные экзамены. Я
это понимаю как его нежелание принимать участие в нашем несерьезном экзамене.
.
Что касается сделать наш разговор деловым, то это уже писем 10 зависит только
от посещаемости нашего экзамена Л.Б.Меклером.
Что касается серьезности нашего разговора, то это также зависит от посещаемости
его Л.Б. Меклером, т.к. нельзя вести серьезный разговор, игнорируя мои
повторяющиеся из письма в письмо вопросы на протяжении десятка писем.
Что касается понятным широкому кругу читателей, то несколько моих знакомы уже
заинтересовались нашей перепиской и с любопытством ждут, спрашивая: "Как там
Лазарь Борисович, не освободился еще от неотложных дел? Не сошел ли
преждевременно с дистанции за прогулы?"
Я им отвечаю: Сойти с дистанции Л.Б. может лишь по собственному желанию, т.к.
экзамен создавался лично для него, поэтому без него он никак не закончится.
Что касается интереса для широкого круга читателей, то меня уже несколько
человек попросили не забыть включить на CD, который они у меня приобретают
переписку с Л.Б.Меклером, т.к. они очень много о нем наслышаны.
Что касается включения в "отгадывание" моей дочурки, то, например,
международный конкурс CASP не ставил ограничений на возраст, пол и
специальность участников. Просто в том серьезном конкурсе моей дочурке было
победить без вариантов, т.к. там требовалось не три буквы угадать, а выдать
координаты всех атомов нескольких десятков крупных белков. В этом конкурсе для
нее есть реальный шанс если не победить, то по крайней мере занять не последнее
место. Дело в том, что она указала пальцем на ту же картинку, что соответствует
букве в столбце Л.Б.Меклера (и в Вашем). Чем черт не шутит, а вдруг ее
предсказания будут не только более быстрыми, но и не менее правильными?
Что касается подрыва надежды, то Вы не волнуйтесь. Научный прогноз всегда
побеждал рулетку. Просто в этом мы должны время от времени убеждаться, чтобы не
потерять квалификацию...
Обидно будет не в том случае, если Люба отгадает не хуже Л.Б. Обидно будет,
если Л.Б. научно предскажет хуже Любы...
П: Теперь по делу.
Л.Б.Меклер ответственно относится к задаче научного предсказания структур
белков на основе его теории и разработанной им соответствующей процедуры
свертывания из цепочки линейных аминокислотных остатков трехмерной конфигурации
"жидкой" молекулы, а из нее "твердой", как это и происходит шаг за шагом в
рибосоме.
K: - Это вселяет надежду на продолжение его участия в нашем конкурсе, простите
экзамене.
П: Как он пояснил, а я об этом ранее сообщил, стопроцентно верный научный
прогноз может быть сделан для фрагмента пептида, входящего в целостную белковую
молекулу, лишь в контексте положения фрагмента в этой молекуле.
K: - Да, я уже в курсе. Именно поэтому я прислал полные последовательности
белков.
П: Будучи занят неотложным "самоэкзаменом", результаты которого весьма
интересны и появятся в свое время, я надеюсь, в научной публикации, он не
располагает временем сейчас на построение трех белков из предложенных Вами трех
аминокислотных последовательностей.
K: Тогда нужно решать, либо мы переносим срок окончания экзамена на более
позднее время, когда Л.Б. освободится от неотложных дел, либо он отказывается
продолжать участие в экзамене. В таком случае нам остается лишь продолжить
экзамен без его участия, т.к. посетители сайта Наномир уже заинтригованы и ждут,
чем же кончится этот конкурс-экзамен. Между прочим этот конкурс-экзамен по сути
своей международный. Дело в том, что Если я живу в Москве, т.е. в Росии, то Л.Б.
Меклер, как мне рассказывали живет за пределами нашей страны. Следовательно наш
конкурс действительно международный. Кто знает, может быть он скоро станет
более престижным, чем CASP, особенно если превзойдет его результатами. А по
моему предположению к этому все идет...
П: Да и, честно говоря, я начинаю сомневаться, стоит ли мне просить его об этом,
коль наш диалог приобретает столь шуточный характер.
K: - Это если сравнивать с очень серьезными экзаменами, которые уже прошел Л.Б.
(с Ваших слов). Я же к этому конкурсу отношусть с полной ответственностью и не
менее серьезно, чем к конкурсу CASP, тем более, что в отличие от CASP в нашем
конкурсе все будет честно и без "технических проблем", из-за которых результаты
некоторых участников могут исчезнуть с сайта CASP.
П: Вы приняли к "зачету" два моих ответа, относящиеся к фрагментам 2 и 3.
Относительно фрагмента №1 Вы утверждаете; "Либо Вы выбираете одну из трех
букв, либо Ваш ответ будет засчитан как неверный. Верный ответ лишь один из
трех. Либо A, либо B, либо С."
Как я сообщал ранее, из пояснений Л.Б.Меклера следует, что в одном фрагменте
может находиться и одна, и другая, и третья структура.
.
.
.
20020121 20.30
П: Александр Юрьевич!
Теперь я понял, что речь идет о трех ранее предложенных Вами пептидах, по
которым решение Л.Б. Меклера я посылал Вам, но Вы пожелали вернуться к ним в
предлагаемой Вами форме. Так?
.
K: - Так.
.
П: Мне нет надобности обращаться к Л.Б. Меклеру, поскольку ответы на Ваши
вопросы имеются из той ранее посланной Вам информации.
.
K: - Нет. Ответа на мой вопрос, какой из трех участков представляет собой
непрерывную альфа-спираль длиной 20 АО у меня до сих пор нет.
.
П: Мои действия.
1. Сверяю аминокислотные остатки. Да, это те же и в той же последовательности.
2. Проставляю номера по порядку для белка
№1 от 1 до 88
№2 от 1 до 117
№3 от 1 до 104
.
3. Проставляю в верхней строке №№ участков "от" и "до", по которым Л.Б.Меклер
определял интересующие Вас вторичные структуры.
Вот они;
Для белка
№1 1-25
№2 91-120
№3 76-104
.
4. Обращаюсь к ранее посланному Вам результату.
Для белка №1 непрерывная альфа - спираль, указанная Л.Б.Меклером,
охватывает АО от №2 до № 16, далее от № 20 до №25
Л.Б.Меклер указал наличие бета - поворота. Обращаю Ваше внимание, что
внутри непрерывной альфа-спирали есть четыре альфа - спирали, перекрыващие
друг друга, а внутри бета поворота есть два, из которых один (20 - 24)
перекрывает другой (21-25).
.
Ваш Павел Червонобродов.
.
K: Меня пока не интересует то, что ответил Л.Б. Меклер, т.к. я не хочу лезть в
дебри его компонент связности. Я специально упростил вопрос. Формулирую его еще
раз: Пусть Л.Б.Меклер выберет один из трех ответов:
.
A) Участок белка N1 является непрерывной альфа-спиралью.
B) Участок белка N1 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N1 является циклом
.
Других вариантов в результатах РСА нет.
.
После ответа на этот вопрос пусть Л.Б. выберет еще один ответ из трех:
.
A) Участок белка N2 является непрерывной альфа-спиралью.
B) Участок белка N2 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N2 является циклом
.
После ответа на этот вопрос пусть Л.Б. выберет еще один ответ из трех:
.
A) Участок белка N3 является непрерывной альфа-спиралью.
B) Участок белка N3 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N3 является циклом
.
Если он выберет правильные ответы, то мы продолжим дискуссию о фолдинге. Если
ошибется, промолчит или начнет рассказывать о своих достижениях и наградах, то
мы с Вами можем продолжать дискуссию, но уже не о фолдинге, т.к. я буду считать,
что задачу фолдинга Л.Б. решить не смог даже в первом приближении.
.
С уважением к Вам и Л.Б.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020121 22.09.
П: Уважаемый Александр Юрьевич!
.
Начать хочу с фактов в моем представлении - не биолога. Для меня это важно в
свете длительного спора с близкими мне людьми, которые говорят: "Если бы Меклер
владел тем, о чем заявляет, то это бы стало достоянием мира, подобно тому как
устами руководителей США и Великобритании было на весь мир объявлено о
расшифровке ДНК Крейгом Винтером и другими учеными, участниками программы
"Геном человека" ".
.
Спор идет и на уровне профессионалов. Вот выдержка из статьи Олега Котова
"Секретные алгоритмы стоят вне науки", опубликованной в газете "Коммерсант" в
связи с семинаром Биохимического общества РАН, посвященном обсуждению теории
Л.Б.Меклера. "... в результате обсуждения мнения о работе разделились: от
восторженных -А.А.Замятнина, В.З.Плетнева, М.А. Молкульского, до взвешенных
- В.Т.Иванова, Д.Г.Кнорре, Л. А. Блюменфельда, Б.К.Вайнштейна и, наконец, до
отрицательных -М.В. Волькенштейна, В.И. Иванова и В.Г. Дашевского. И в
настоящее время соображения, подобные предложенным Л.Б.Меклером, находятся в
русле активной дискуссии. Работы Меклера - Идлис цитируются".
.
Мне хотелось бы, чтобы наш разговор был понятен для не биологов. Тогда он будет,
я надеюсь, интересен, так как касается актуальной научной проблемы,
затрагивающей интересы обеспечения здоровья людей, и не только.
.
Я думаю, что состояние того решения, которое имеет Л.Б.Меклер по проблеме
фолдинга относится к варианту №2, который Вы опредилили; "Есть товар, есть
начальный капитал. Проводится рекламная кампания, и товар начинает продаваться.
Есть справки или нет, для хорошего товара большого значения не имеет, т.к. он
не вызовет нареканий"
.
О том, что НОУ-ХАУ Л.Б. Меклера - это способ с помощью компьютерной программы
получить хороший товар, понимают те, кто готовы щедро финансировать ее
изготовление.
.
На сегодняшний день Л.Б.Меклер может согласиться только с тем инвестором,
который в условиях договора с ним, обеспечит использование компьютерной
программы реализации процесса фолдинга только на благо людей. И пока в этом
состоит загвоздка, которую - есть на то основание - удасться преодолеть.
.
Ваш Павел Червонобродов
.
K: Если Л.Б. отгадает типы тех самых трех участков, о которых мы беседуем уже
вторую неделю, то эту загвоздку мы будем решать вместе.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020122 08.00
K: Здравствуйте, уважаемый Павел Леонович!
Попытайтесь сосредоточиться и понять меня.
1. Л.Б. Меклер передал мне данные по трем участкам белков N1, N2, N3.
2. В N1, N2, N3 по Меклеру содержатся альфа-спирали.
3. Один из белков в этой экзаменационной задаче - фиброин (классическая
бета-структура, в которой нет ни одной альфа-спирали).
.
Если Л.Б. будет настаивать, что в фиброине есть альфа-спирали, то это то же
самое, что настаивать на том, что в конструкции велосипеда есть дизельный
двигатель от самосвала.
.
У Л.Б. осталось два варианта: Либо пересмотреть свои данные и угадать, какой из
трех белков - фиброин, либо о фолдинге Меклера не может быть и речи.
.
Если в вопросе о наличии альфа-спиралей в бета-фиброине его будут поддерживать
профессора и академики, то пусть они занимаются проблемой фолдинга, но без
моего участия.
.
Таким образом, продолжать разговор о фолдинге Л.Б.Меклера мы сможем только при
условии пересмотра Л.Б.Меклером своих данных (N1,N2,N3) и угадыванием, какой из
этих участков принадлежит фиброину.
.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020122 23.16 - 00.29 Тема: Последний шанс для фолдинга Л.Б. Меклера
П: Уважаемый Александр Юрьевич!
.
Фиброин - это третий из трех пептидов (участков - в Вашем обозначении).
.
К: Я на память не помню, сейчас буду смотреть, но можно начать с комплимента
Лазарю Борисовичу за смелость попытаться отгадать одну из трех структур. При
этом вероятность удачи всего 1/3.
.
Я правильно понимаю, что Лазарь Борисович имеет в виду, что фиброину
соответствует структура N3, аминокислотная последовательность которой:
.
Аминокислотная последовательность белка N3:
.
MET-ARG-VAL-ARG-ALA-LEU-ARG-LEU-ALA-ALA-LEU-VAL-GLY-ALA-GLY-ALA-ALA-LEU-ALA-
LEU-SER-PRO-LEU-ALA-ALA-GLY-PRO-ALA-SER-ALA-ASP-THR-THR-VAL-SER-GLU-PRO-ALA-
PRO-SER-CYS-VAL-THR-LEU-TYR-GLN-SER-TRP-ARG-TYR-SER-GLN-ALA-ASP-ASN-GLY-CYS-
ALA-GLN-THR-VAL-THR-VAL-LYS-VAL-VAL-TYR-GLU-ASP-ASP-THR-GLU-GLY-LEU-CYS-TYR-
ALA-VAL-ALA-PRO-GLY-GLN-ILE-THR-THR-VAL-GLY-ASP-GLY-TYR-ILE-GLY-SER-HIS-GLY-
HIS-ALA-ARG-TYR-LEU-ALA-ARG-CYS-LEU
.
Чтобы не ошибиться в спешке я хочу, чтобы Лазарь Борисович проверил, что это -
третий из трех пептидов. Если Л.Б. подтверждает, что это последовательность
фиброина, то я присылаю структуру этого белка, его полное название и свою
модель тоже.
.
П: Вы вправе спросить, как это может быть, ведь известно, что фиброин - это
классическая бета-структура, в которой нет ни одной альфа-спирали, тогда как в
посланном мной Вам ранее сообщении показывалось, что третий пептид состоит из
восьми альфа-спиралей.
.
(Тут я должен ивиниться, так как обнаружил свою ошибку, а именно - пропустил
П - К связь 89 -93 и, следовательно, должен был показывать не восемь, а девять
П-К связей, или иначе - три смешанных спиральных фрагмента, каждый из которых
формируется тремя П-К связями в шаге три или четыре, и поэтому все три данных
фрагмента этого пептида №3 лишь частично устойчивы, ибо полностью устойчив
фрагмент алфа-спиралей, сформированный, как минимум, четырьмя перекрывающимися
П - К связями).
.
K: Это мы обсудим после проверки. Я еще сам не знаю, угадали Вы или нет. Пока
Вы будете проверять, правильно ли я Вас понял, я посмотрю, "кто" у нас пептид N3.
.
П: Теперь отвечаю на вопрос, с которого начал. Дело в том, что сообщая мне
результаты, Л.Б. Меклер предупредил, что в зависимости от количества П-К связей
и их суммарной энергии может быть переход из структуры альфа-спирали в
бета-структуру. Я этому не придал значения. А теперь оказалось, что как раз
третий пептид - тому блистательный пример, так как в нем одиннадцать подряд П-К
связей без единого пропуска - это физическая основа прочности фиброина шелка.
.
K: Это мы тоже обсудим после окончательной проверки.
.
П: Ниже привожу иллюстрацию сказанному, позволяющую понять механизм перехода из
одной структуры в другую (по ходу формирования данной структуры в растворе -
это было сказано мне изначально)
.
Пептид ( участок) №1
а/ то, что я посылал
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25
M L T V E I H D S Q V S V L E R S G V S Q K S G K
I______ I
эта скобка символизирует П-К связь между двумя АО - 2 и 5 (альфа 3/10)
Скобки 4-8 7-11 10-14 12-16 это пять П-К связей непрерывной альфа-спирали
Скобки 20-24 21-25 это два бета-поворота
б/ то, что получилось после перехода в бета-структуру
M L T V E I H D S Q V
I \ \ / I I S здесь образовалось шесть П-К связей
K G S K Q S V G S R E L V
Пептид (участок) № 3
а/ то, что я посылал
76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104
Y A V A P G Q I T T V G D G Y I G S H G H A R Y L A R C L
I___________I
эта скобка символизирует П-К связь между двумя АО 77 и 81 (альфа 4/10 )
скобки 77-81 80-84 81-85 (три перекрытия) 86-90 89-93 91-94 (еще три перекрытия)
95-98 96-99 97-101 (еще три перекрытия) - итого девять П-К связей альфа-спиралей.
Три фрагмента по три, поэтому неустойчивые (в спектрах кругового дихроизма будут выглядеть
как фрагмент 75% альфаспирализации).
б/ то, что получилось после перехода в бета-структуру
Y A V A P G Q I T T V G D G Y
I I I I I I I I I I I I
L C R A L Y R A H G H S G
Обращает на себя внимание тот знаменательный факт, что данная бета-структура
сформирована одиннадцатью рядом стоящими П-К связями без единого пропуска -
структурно-генетическое выражение удивительной прочности фиброина.
.
Из показанного видно, что ответ на вопрос - будет ли тот или иной фрагмент
бирпрлипептида альфа-спиралью, совокупностью бета-изгибов или бета-структурой
достигается построением соответствующих моделей согласно П-К коду ОСГК, и
выбором из них той модели, которая содержит максимальное число П-К связей, а
при равенстве числа связей выбором энергетически более устойчивой модели, а при
равной устойчивости - большим числом энергетически более сильных П-К связей.
.
Итак, результат экзамена - четыре верно построенных моделей (включая из Вашей
статьи). Теперь Вы можете сказать то, что собирались - "Л.Б.Меклер - Вы бог" ?
.
Ваш Павел Червонобродов.
.
K: Ну, Вы крут, Павел Леонович! После Вашего утверждения, что в результате
экзамена верно решено 4 задачи из 3 (!) я сразу вспомнил студенческую
самодеятельность. Там на сцену выходил "строгий профессор" и говорил:
"Та-акс... За 14 секунд мы, точнее Вы должны решить 10 задач из 7..."
.
Вы не видели эту сценку?
.
Давайте договоримся, что в экзаменационную задачу мы не будем включать ничего
постороннего. А то может получиться как с соавторами: сначала к автору
присоединяется куча соавторов, потом автора отодвигают в конец списка, а на
третьей стадии список укорачивают.
.
Мне не хотелось бы, чтобы с нашей экзаменационной задачей случилась аналогичная
история. Участок белка из моей статьи не входит в нашу экзаменационную задачу.
Какой смысл давать на экзамене вопрос в комплекте с ответом? Если мне не
изменяет память, то я привел пример из своей статьи, отвечая на Ваш вопрос:
Вопрос Павла Леоновича: П: Как выглядят составляющие структуры?
.
Ответ Кушелева: Альфа-спиральный участок - красного цвета (слева).
Бета-спиральный - в середине. Цикл - справа. В данных РСА красный участок
обозначен, как HELIX от N до M, где N - начало участка из 20 аминокислотных
остатков, а M - конец участка из 20 аминокислотных остатков. M - N = 20.
.
Вопрос Павла Леоновича: Как выглядят эти же структуры РСА?
.
Ответ Кушелева: Если Вы о третичной структуре, то в виде координат атомов, а
если Вы спрашиваете о данных РСА по вторичной структуре, то в виде слова
HELIX (спираль) или SHEET (бета-слой), TURN (поворот).
.
В моей научной статье Вы можете найти такой пример. Привожу его для наглядности
в текте: ...
.
Конец цитаты.
.
Итак, это был пример, а вовсе не часть экзамена. Не будем включать этот пример
в наш экзамен, чтобы не получилось как с автором, которого сократили из общего
списка соавторов.
.
Теперь давайте разберемся с Вашим утверждением: "Итак, результат экзамена -
четыре верно построенных моделей (включая из Вашей статьи)."
.
Из этих 4 мы сразу вычтем "включая из статьи", т.к. этот пример в экзамен не входит.
Из оставшихся 3 я пока что вижу одно утверждение, что третий пептид - фиброин.
Если окажется, что Л.Б. угадал, то должно остаться еще 2 правильных ответа.
.
Рассматривая структуру пептида N1 я не понимаю, к какому классу пептидов ее
причислил Л.Б. Он пишет, что пептид N1 переходит в бета-структуру. Что это
значит? Пептид N1 - тоже является бета-нитью? Или он образует цикл? А может
быть он переходит обратно в альфа-спираль?
.
Пусть Л.Б. сделает выбор:
A) Пептид N1 - это альфа-спираль без включений бета-структуры
B) Пептид N1 - это бета-нить без включения альфа-спиралей
C) Пептид N1 - это бета-нить, в которой последний пептид химически связан с
первым (без включения альфа-спиралей)
.
Если Л.Б. сделает окончательный выбор для пептида N1, то его ответ будет принят
и рассмотрен. Это будет второй ответ из 3.
.
Ну и третий ответ - это выбор:
.
A) Пептид N2 - это альфа-спираль без включений бета-структуры
B) Пептид N2 - это бета-нить без включения альфа-спиралей
C) Пептид N2 - это бета-нить, в которой последний пептид химически связан с
первым (без включения альфа-спиралей)
.
Если Л.Б. сделает окончательный выбор для пептида N2, то его ответ будет принят
и рассмотрен. Это будет третий ответ из 3.
.
На самом деле, если два белка из трех определены, то третий определяется
однозначно. Мне этот третий ответ нужен для "контроля на четность".
.
Таким образом вероятность угадать три белка из трех составляет 1/6, т.е.
похожа на вероятность выстрела в "Русской рулетке".
.
Итак, я жду обещанных 3 правильных ответа. (4 из 3 - это согласитесь, будет уже
перебор)
.
С уважением к Вам и Л.Б.
Еще раз отдаю честь Лазарю Борисовичу за смелость.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020123 16.00
П: Уважаемый Александр Юрьевич!
.
Согласен с Вами - пример из Вашей статьи не будем включать в "экзамен". Это для
меня было подтверждением умения Л.Б. Меклера предсказывать вторичные структуры.
И кроме того, было интересно отметиь, что Ваш и его результаты ложатся в рамки
высказанного Вами ранее отношения к подобным предсказаниям.
.
1. Подтверждаю, что пептид №3 взят из белка, о котором Вы спрашиваете.
.
2. Отвечаю на Ваш вопрос:
"Рассматривая структуру пептида N1 я не понимаю, к какому классу пептидов ее
причислил Л.Б. Он пишет, что пептид N1 переходит в бета-структуру. Что это
значит? Пептид N1 - тоже является бета-нитью? Или он образует цикл? А может
быть он переходит обратно в альфа-спираль?"
.
В свете пояснений о критериях устойчивости и выборе из нескольких состояний
наиболее устойчивой структуры, я думаю, что шесть разорванных П - К связей
пептида №1 в состоянии бета-структуры менее устойчивы, чем пять перекрывающих
друг друга П - К связей (см. ниже "скобки" 2 - 5, 4 - 8, 7 - 11, 10 - 14,
12-16), образующих непрерывную альфа-спираль от АО №2 до АО № 16, а в интервале
от АО №20 до АО 25 находятся два перекрывающих друг друга бета-поворота.
Следовательно, этот пептид смешанный.
.
K: -Мне нравится ход Ваших мыслей, поэтому предлагаю принять участие в виде
отдельного экзаменуемого.
.
Я правильно понял, что Вы (Павел Леонович) пептид N1 причисляете к:
.
A) Участок белка N1 является непрерывной альфа-спиралью.
B) Участок белка N1 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N1 является циклом
.
Назовите букву, т.к. любой другой ответ будет расценен как неверный.
.
А еще я хотел бы знать, как считает лично Л.Б. (мне интересно, кто из Вас лучше
предскажет. Если Л.Б., то фармацевтические фирмы захотят заключить договор с
ним, а если Вы, то с Вами).
.
П: 3. По поводу пептида №2 попробуйте, используя ранее посланный ответ
Л.Б.Меклера по этому пептиду и пояснения о компонентах связности и П-К коде не
"одгадать", а научно предсказать (именно это делает Л.Б.Меклер) устойчивую
структуру, используя описание П-К кода в имеющейся у Вас статье Л.Б.Меклера и
Р.Г.Идлис ("Природа", №5, 1993), Если не захотите провести такой экперимент, то
ответ, разумеется, за мной.
.
Ваш Павел Червонобродов.
.
K: - На счет пептида N2 Вы делаете мне довольно соблазнительное предложение,
т.к. во-первых я знаю правильный ответ, во-вторых, если Вы пришлете данные по
пептиду N1 (можно свои, но данные Л.Б. Меклера обязательно, иначе он может
досрочно выбыть из участников экзамена за "прогулы"), то методом исключения
можно написать данные для пептида N2.
.
Но я бы предпочел закончить с экзаменом Л.Б.Меклера. Если его секретное Ноу-Хау
сработает, согласно Вашему выражению:
"...попробуйте... не "отгадать", а научно предсказать (именно это делает
Л.Б.Меклер)" (конец цитаты),
то я с удовольствием буду разбираться с технологией, если у меня хватит на нее
денег...
.
Итак, я жду выбор Л.Б. Меклера и, если Вы тоже хотите принять участие, как
независимый специалист, то отдельно Ваш быбор для пептидов N1, N2, N3.
.
Короче, заполняйте таблицу:
. Меклер Червонобродов РСА
N1 ? ? ?
N2 ? ? ?
N3 B ? ?
.
Пока что в этой таблице, как мы с Вами можем видеть, только одна конкретная
буква, означающая, что Л.Б. считает, что пептид N3 соответсвует строке:
B) Участок белка N3 является бета-нитью без включения альфа-спиральных участков.
.
Я жду еще две буквы от Л.Б. Меклера, и если хотите, то три буквы от Вас.
Последние три буквы (столбец РСА) заполняются сразу после заполнения столбца
Л.Б. Меклера. Ваш столбец Вы заполняете по желанию, т.е. хотите - заполняйте,
хотите - нет.
.
Передайте, пожалуйста Л.Б. Меклеру, что его "прогулы", т.е. отсутствие данных
по пептиду N1 и N2 в очередном письме, расцениваются как неуважительное
отношение к экзамену. Я, как Вы уже убедились, "экзаменатор терпеливый", но что
подумают читатели энциклопедии Наномир? Скажут: "Что это, он так тянет с
ответом? Ай-яй-яй..."
.
С уважением и надеждой на скорейший ответ Л.Б. Меклера (заполнение таблицы:
N1-?
N2-?
N3-B,
которая заполнена уже на одну треть (что все-таки радует)).
.
Ваш Кушелев
nanoworld@bigfoot.com
.
.
.
20020123 20.44
.
П: Уважаемый Александр Юрьевич!
.
1.На Ваш вопрос:
.
"Я правильно понял, что Вы (Павел Леонович) пептид N1 причисляете к:
.
A) Участок белка N1 является непрерывной альфа-спиралью.
B) Участок белка N1 является бета-нитью без включения альфа-спиральных участков.
C) Участок белка N1 является циклом"
.
я уже дал ответ. Если хотите его увидеть ответ в форме букв, то отвечаю -
смесь "А" и "В".
.
K: Если Вы внимательно читали мое письмо, то, вероятно заметили фразу:
Назовите букву, т.к. любой другой ответ будет расценен как неверный.
.
Заметьте, букву, а не смесь, комбинацию или конгломерат. Либо Вы выбираете одну
из трех букв, либо Ваш ответ будет засчитан как неверный. Верный ответ лишь
один из трех. Либо A, либо B, либо C. Прежде чем отсылать Ваш ответ проверьте,
совпадает ли он с предлагаемыми вариантами. Если не совпадает, то Вы заведомо
посылаете неправильный ответ. Даю Вам еще одну попытку исправиться.
.
П: 2. Ваше высказывание:
.
"А еще я хотел бы знать, как считает лично Л.Б. (мне интересно, кто из Вас
лучше предскажет. Если Л.Б., то фармацевтические фирмы захотят заключить
договор с ним, а если Вы, то с Вами)"
.
я воспринимаю как шутку, ибо мои "предсказания" - это лишь попытка
использовать то, что я услышал от Л.Б.Меклера. И уж конечно смешно говорить,
что со мной "фармацевтические фирмы захотят заключить договор".
.
К: Если Вы пытаетесь использовать то, что услышали от Л.Б. Меклера, то прежде,
чем посылать его предполагаемый ответ, сообщите Меклеру, что в случае Вашей
ошибки он лишится потенциальных заказчиков. Уточните у него, подтверждает он
Ваш предполагаемый ответ или нет (если Вас интересует результат экзамена).
.
П: 3. Предлагая Вам ответить на вопрос о пептиде № 2, я имел в виду
воспроизведение процедуры выбора устойчивой конфигурации из возможных на основе
указанных Л.Б.Меклером критериев.
Коль Вы не готовы включиться в это действо, то сообщаю свой ответ - "А".
.
Итак, заполняю Вашу таблицу
.
Меклер Червонобродов РСА
N1 ? А и В ?
N2 ? А ?
N3 B В ?
.
Что касается Л.Б.Меклера, он уже выдержал серьезные экзамены (о них я Вам
сообщал). Сейчас он занят специальным "самоэкзаменом", в ходе которого
придирчиво проверяет свое Ноу-Хау и я считаю для себя не этичным ставить перед
ним вопросы в порядке экзамена.
Если мои ответы окажутся правильными, то рассматривайте их как его ответы.
.
Ваш Павел Червонобродов.
.
K: Уважаемый Павел Леонович!
.
1. Что касается заполнения таблицы, то если Вы прочитали мое письмо, то там
было написано:
.
Последние три буквы (столбец РСА) заполняются сразу после заполнения столбца
Л.Б. Меклера.
Ваш столбец Вы заполняете по желанию, т.е. хотите - заполняйте, хотите - нет.
.
Я вижу, что Вы изъявили желание принять участие в этом экзамене, примите мои
поздравления! Однако, Вы сходу обогнали Л.Б. Меклера по "посещаемости" вдвое,
т.е. Ваши два из трех ответа принимаются к рассмотрению. Столбец данных РСА я
заполню сразу, как только Л.Б. лично примет участие (после серьезных экзаменов)
в моем несерьезном экзамене. Дейстительно, что это за экзамен, где требуется
дать ответ, состоящий всего из трех букв?
.
Мне жена как раз говорила в прошлый раз: "Что за ерундой ты занимаешься?
Сколько можно одинаковых вопросов по почте посылать?". Вы (П.Л. и моя жена)
убедили меня, что экзамен действительно серьезным назвать трудно, поэтому у
меня возникла классная идея:
.
Тут у меня мимо экрана компьютера постоянно проползает любопытная дочка. Ей на
днях исполнилось уже 8 месяцев.
.
Я и подумал: если все вокруг считают этот экзамен несерьезным, то почему бы и
ей не поучаствовать?
.
Она уже умеет говорить "Да, нет", показывать пальцем на то, что ей больше
нравится. Я ей тоже задам по каждому из трех белков по три вопроса и посмотрю,
на какую из трех цветных картинок она покажет. Чем черт не шутит, а вдруг
угадает?!
.
Итак, в нашем несерьезном конкурсе уже 3 участника, не считая РСА:
.
Меклер Червонобродов Люба РСА
N1 ? ? ? ?
N2 ? A ? ?
N3 B B ? ?
.
Смотрите-ка! Таблица постепенно заполняется. Пока лидирует П.Л.
.
Жаль, что наш несерьезный экзамен проходит так медленно, как говориться в час
по чайной ложке. Но конкурс CASP, в котором участвовала наша лаборатория
Наномир, длился еще дольше (около двух месяцев). Каждую неделю нам присылали
пару-тройку белков и мы должны были в течение 24 часов прислать ответ. Он сразу
выставлялся на сервер. Наши ответы продержались после окончания конкурса всего
неделю, а потом их стерли, однако если они Вас заинтересуют, то Вы их можете
посмотреть на нашем сервере в разделе "Переписка". Их можно найти по ключевому
слову "CASP".
.
Но, вернемся к нашей таблице. Условие экзамена, что столбец РСА заполняется
после столбца Меклера остается в силе. Если Л.Б. не хочет продолжать участие в
конкурсе, то пусть скажет об этом лично. Ведь насильно никто не заставляет...
.
Правда, для меня это будет означать, что он не в состоянии определить структуру
остальных пептидов даже по своей собственной оценке.
.
В этом случае мы можем дальше продолжить экзамен с оставшимися двумя
участниками. В конце концов одному из участников могут достаться не только
слава и почет, но и заказы фармацевтических фирм.
.
Если раньше я Вам писал, что мы не занимаемся переговорами с фармацевтическими
фирмами, то пока шел экзамен, мне прислали 2 письма из Китая и Гон-Конга. Я не
уверен, что это - фармацевтические фирмы, но их интересуют как раз белки.
.
Я бы на Вашем месте предоставил Л.Б. Меклеру решать судьбу его Ноу-Хау ему
самому, а то ведь обидится на Вас, если Вы будете решать за него.
.
С уважением
к серьезным участникам
несерьезного экзамена.
Ваш Александр Кушелев
nanoworld@bigfoot.com
.
.
.
20020124 17.00
Александр Юрьевич!
.
Справимся ли мы с задачей сделать наш разговор деловым, серьезным, понятным и
интересным для широкого круга читателей Вашего сайта?
.
Ваш пассаж с включением в "отгадывание" Вашей дочурки подрывает на это надежду.
.
K: Начнем с того, что на мой вопрос о причине "прогуливания нашего экзамена"
господином Меклером Вы заявили, что он уже прошел очень серьезные экзамены. Я
это понимаю как его нежелание принимать участие в нашем несерьезном экзамене.
.
Что касается сделать наш разговор деловым, то это уже писем 10 зависит только
от посещаемости нашего экзамена Л.Б.Меклером.
Что касается серьезности нашего разговора, то это также зависит от посещаемости
его Л.Б. Меклером, т.к. нельзя вести серьезный разговор, игнорируя мои
повторяющиеся из письма в письмо вопросы на протяжении десятка писем.
Что касается понятным широкому кругу читателей, то несколько моих знакомы уже
заинтересовались нашей перепиской и с любопытством ждут, спрашивая: "Как там
Лазарь Борисович, не освободился еще от неотложных дел? Не сошел ли
преждевременно с дистанции за прогулы?"
Я им отвечаю: Сойти с дистанции Л.Б. может лишь по собственному желанию, т.к.
экзамен создавался лично для него, поэтому без него он никак не закончится.
Что касается интереса для широкого круга читателей, то меня уже несколько
человек попросили не забыть включить на CD, который они у меня приобретают
переписку с Л.Б.Меклером, т.к. они очень много о нем наслышаны.
Что касается включения в "отгадывание" моей дочурки, то, например,
международный конкурс CASP не ставил ограничений на возраст, пол и
специальность участников. Просто в том серьезном конкурсе моей дочурке было
победить без вариантов, т.к. там требовалось не три буквы угадать, а выдать
координаты всех атомов нескольких десятков крупных белков. В этом конкурсе для
нее есть реальный шанс если не победить, то по крайней мере занять не последнее
место. Дело в том, что она указала пальцем на ту же картинку, что соответствует
букве в столбце Л.Б.Меклера (и в Вашем). Чем черт не шутит, а вдруг ее
предсказания будут не только более быстрыми, но и не менее правильными?
Что касается подрыва надежды, то Вы не волнуйтесь. Научный прогноз всегда
побеждал рулетку. Просто в этом мы должны время от времени убеждаться, чтобы не
потерять квалификацию...
Обидно будет не в том случае, если Люба отгадает не хуже Л.Б. Обидно будет,
если Л.Б. научно предскажет хуже Любы...
П: Теперь по делу.
Л.Б.Меклер ответственно относится к задаче научного предсказания структур
белков на основе его теории и разработанной им соответствующей процедуры
свертывания из цепочки линейных аминокислотных остатков трехмерной конфигурации
"жидкой" молекулы, а из нее "твердой", как это и происходит шаг за шагом в
рибосоме.
K: - Это вселяет надежду на продолжение его участия в нашем конкурсе, простите
экзамене.
П: Как он пояснил, а я об этом ранее сообщил, стопроцентно верный научный
прогноз может быть сделан для фрагмента пептида, входящего в целостную белковую
молекулу, лишь в контексте положения фрагмента в этой молекуле.
K: - Да, я уже в курсе. Именно поэтому я прислал полные последовательности
белков.
П: Будучи занят неотложным "самоэкзаменом", результаты которого весьма
интересны и появятся в свое время, я надеюсь, в научной публикации, он не
располагает временем сейчас на построение трех белков из предложенных Вами трех
аминокислотных последовательностей.
K: Тогда нужно решать, либо мы переносим срок окончания экзамена на более
позднее время, когда Л.Б. освободится от неотложных дел, либо он отказывается
продолжать участие в экзамене. В таком случае нам остается лишь продолжить
экзамен без его участия, т.к. посетители сайта Наномир уже заинтригованы и ждут,
чем же кончится этот конкурс-экзамен. Между прочим этот конкурс-экзамен по сути
своей международный. Дело в том, что Если я живу в Москве, т.е. в Росии, то Л.Б.
Меклер, как мне рассказывали живет за пределами нашей страны. Следовательно наш
конкурс действительно международный. Кто знает, может быть он скоро станет
более престижным, чем CASP, особенно если превзойдет его результатами. А по
моему предположению к этому все идет...
П: Да и, честно говоря, я начинаю сомневаться, стоит ли мне просить его об этом,
коль наш диалог приобретает столь шуточный характер.
K: - Это если сравнивать с очень серьезными экзаменами, которые уже прошел Л.Б.
(с Ваших слов). Я же к этому конкурсу отношусть с полной ответственностью и не
менее серьезно, чем к конкурсу CASP, тем более, что в отличие от CASP в нашем
конкурсе все будет честно и без "технических проблем", из-за которых результаты
некоторых участников могут исчезнуть с сайта CASP.
П: Вы приняли к "зачету" два моих ответа, относящиеся к фрагментам 2 и 3.
Относительно фрагмента №1 Вы утверждаете; "Либо Вы выбираете одну из трех
букв, либо Ваш ответ будет засчитан как неверный. Верный ответ лишь один из
трех. Либо A, либо B, либо С."
Как я сообщал ранее, из пояснений Л.Б.Меклера следует, что в одном фрагменте
может находиться и одна, и другая, и третья структура.
Не входя на данном этапе в нюансы, желая получить Ваш ответ, отвечаю фрагмент
№1 - это "А".
Мои ответы - это ответы Л.Б. Меклера. Жду Ваши резкльтаты и РСА.
В надежде на серьезное продолжение разговора.
Ваш Павел Червонобродов
K: Если Ваши ответы - это ответы Меклера, то я надеюсь, что Вы поставили его в
известность, что принимаете решение отстранить его от нашего конкурса?
Подтвердите пожалуйтса окончательную таблицу:
Меклер Червонобродов Люба РСА
N1 ? A A ?
N2 ? A C ?
N3 B B B ?
Если Л.Б. Меклер отказывается заполнить свой столбец, то подтвердите
окончательные данные в таблице и то, что Л.Б.Меклер уведомлен Вами о досрочном
выбытии с экзамена.
С уважением, Ваш Александр Кушелев
nanoworld@bigfoot.com
 Если Вы зайдете на один из моих сайтов по адресу: http://www.nanoworld.narod.ru/,
то увидите приблизительно такую обложку сайта Наномир. Это не главный сайт
Наномир на decsy.ru, однако для международного конкурса он подходит лучше, т.к.
у него более широкий трафик с другими странами. Его дизайн и поддержку
осуществляет один из сотрудников лаборатории Наномир, Олег Сафонов.
Кстати, если Вы хотите опубликовать результаты, представленные Л.Б. Меклером на
международный конкурс по предсказанию структуры белка, который с Вашей подачи
стартовал на сервере narod.ru (очень популярный не только в России сервер), то
могу предложить свою помощь. Дело в том, что живя в Москве мне не трудно передать
подготовленный Вами материал (не обязательно по этому конкурсу, а, например тот,
о котором Вы говорили, что он должен скоро быть опубликован, т.е. над которым
в настоящее время работает Л.Б.) в журнал Природа, где был в 1993г. опубликован
материал Л.Б. Меклера и Розы Идлис. Читатели, вероятно, с большим интересом
прочтут о новых результатах и усовершенствованной методике Л.Б.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
Если Вы зайдете на один из моих сайтов по адресу: http://www.nanoworld.narod.ru/,
то увидите приблизительно такую обложку сайта Наномир. Это не главный сайт
Наномир на decsy.ru, однако для международного конкурса он подходит лучше, т.к.
у него более широкий трафик с другими странами. Его дизайн и поддержку
осуществляет один из сотрудников лаборатории Наномир, Олег Сафонов.
Кстати, если Вы хотите опубликовать результаты, представленные Л.Б. Меклером на
международный конкурс по предсказанию структуры белка, который с Вашей подачи
стартовал на сервере narod.ru (очень популярный не только в России сервер), то
могу предложить свою помощь. Дело в том, что живя в Москве мне не трудно передать
подготовленный Вами материал (не обязательно по этому конкурсу, а, например тот,
о котором Вы говорили, что он должен скоро быть опубликован, т.е. над которым
в настоящее время работает Л.Б.) в журнал Природа, где был в 1993г. опубликован
материал Л.Б. Меклера и Розы Идлис. Читатели, вероятно, с большим интересом
прочтут о новых результатах и усовершенствованной методике Л.Б.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
20020124 23.30
П: Александр Юрьевич!
1. Давайте условимся, что мы не играем в "отгадывание" и поэтому присутствие
Вашей дочурки в Вашей таблице ответов неуместно.
K: Я выполняю Вашу просьбу и вычеркиваю ее из участников конкурса, тем более,
что она не против. На мой вопрос: "Хочешь, я вычеркну тебя из участников
международного конкурса по предсказанию структуры белков?" она не задумываясь
ответила: "Да". Она вообще не любит говорить "Нет".
П: 2.Если разговор продолжится в серьезном тоне, то можно надеяться получить от
Л.Б.Меклера доступные для понимания не биолога пояснения, как с использованием
П-К кода (на основе научной теории) строится фрагмент пептида (но с поправкой
на возможное изменение его структуры при его нахождении в целостной молекуле).
K: Несомненно, разговор продолжается в серьезном тоне, а доступные для
понимания не биолога пояснения жаждут получить уже несколько не биологов, но
посетителей сайта Наномир. В частности, для представителей китайской фирмы я
даже заказал перевод на китайский язык. Первая часть перевода (оглавление всех
текстов энциклопедии Наномир) уже выполнена. Если Вам интересно, могу прислать.
Для того, чтобы прочитать текст на китайском языке нужно скачать китайский фонт.
Если Вам понадобится вести переписку с этой или другой китайской фирмой (нельзя
сбрасывать со счета то обстоятельство, что население Китая перевалило за
миллиард...), то могу прислать ссылку, где взять фонт (иероглифы).
П: 3. Тогда станет ясно, что предложенная Вами альтернатива из трех структур
(А или В или С) является частным случаем и отнюдь не исчерпывает все возможные
варианты.
K: Так-то оно так, ежели конечно, однако по данным РСА мы имеем дело с тремя
структурами (A, B и C). Я не против, что модели Л.Б.Меклера могут быть точнее
моделей, построенных по РСА, но тогда неуместно заявление Л.Б. о том, что его
данные по всем построенным им белкам отличаются от данных РСА не больше, чем на
один-два аминокислотных остатка.
Либо совпадение есть, и тогда данные Л.Б.Меклера должны совпасть с данными РСА
в нашем экзамене или конкурсе, как Вам больше нравится.
Либо данные Л.Б.Меклера точнее данных РСА, тогда я хотел бы услышать от
Л.Б.Меклера фразу: "Мои данные не обязаны совпадать с данными РСА, т.к.
данные РСА могут быть ошибочными, причем в случае структур A,B,C ошибка может
достигать 20 аминокислотных остатков".
Если так, то я не против, что данные Л.Б.Меклера могут и не совпасть с данными
РСА совершенно.
Если же Л.Б. просто проигнорирует этот выбор, то экзамен снова застопорится,
т.к. мы имеем дело с принципиальным вопросом: Что мы ждем от этого экзамена?
Совпадения данных Л.Б.Меклер - РСА или это совпадение не имеет значения для
подтверждения теории Л.Б.Меклера.
Согласитесь, что в случае, если совпадение предсказаний Л.Б. Меклера с данными
РСА не имеет значения, то этот экзамен тоже не имеет смысла ни начинать, ни
продолжать, ни заканчивать. Или я не прав?
П: 4.И вот в этом частном случае ответ Л.Б.Меклера:
Меклер Кушелев РСА
N1 A ? ?
N2 A ? ?
N3 B ? ?
Я не могу принять эти данные к рассмотрению по двум причинам.
1. Нужно определиться в вопросе, должны ли совпасть данные Л.Б.Меклера с
данными РСА с точностью не хуже 20 аминокислотных остатков?
2. По данным РСА все три белка имеют разные структуры, поэтому повторение букв
(AA, BB, CC) - это заведомо неправильный ответ.
Даю Вам шанс еще раз хорошенько подумать, построить, если это необходимо модели
белков целиком, посмотреть взаимовлияние всех участков, а после этого продолжить
участие в экзамене. Не забывайте, что речь идет о серьезном деле. Если
Л.Б.Меклер наспех пришлет недоделанные модели, они из-за недоделок могут не
совпасть с данными РСА. Это произведет крайне удручающее впечатление на
потенциальных заказчиков. Они могут сказать: Если у Л.Б. не нашлось времени,
чтобы продемонстрировать всему миру работоспособность его Ноу-Хау, то у него
может не хватить времени и на конкретный заказ от нашей фармацевтической (или
другой) фирмы.
Мы изготовим лекарство по недоделанной модели, начнем его продавать, а потом,
когда пациенты начнут ощущать на себе "сырой продукт", может начаться судебное
разбирательство. Если при этом выяснится, что лекарство изготовлено по
недоделанной модели, поэтому оно действует не так, как планировалось, то фирма
может потерпеть не просто убытки, а полный крах.
Поэтому я считаю, что представителям потенциальных заказчиков нужно
предоставить товар лицом. Нужно убедить их в том, что проверка прошла по полной
программе, что ошибки исключены.
Представьте себе, что я передам им Вашу фразу:
П: Ответ Л.Б.Меклера относится к вырезанным пептидам, Однако очень часто бывает,
что отдельные спирали и бета-структуры автомны в трехмерной молекуле. Если это
такой случай, то будет совпадение с рентгеном. Если нет, то верность этого
предсказания можно проверить единственным способом: синтезировать пептиды в
соответствующем растворе и определить степень их кругового дихроизма при
соответствующей температуре И тогда убедиться в верности предсказания. Первый
пептид покажет 80% альфаспирализации, второй пептид - 60% альфаспирализации,
40 % бета -структуры, третий пептид - около 75% бета - структуры.
Павел Червонобродов
K: А они меня спросят: А какой процент альфа-спирализации у фиброина? Он
совпадает с каким-либо из цифр: 60%, 40%, 75%? А я им могу только посоветовать
обратиться к научным статьям, где про фиброин четко сказано, что альфа-структуры
в нем 0 целых, 0 десятых. Я говорю именно о том самом фиброине, который
присутствует в нашем конкурсе. Я бы не стал предлагать Л.Б.Меклеру участок
фиброина, если бы не был уверен в том, что именно на этом участке процент
альфа-спирализации строго равен нулю, т.к. на этом участке нет ни одной
альфа-спирали по данным из разных источников. Если Л.Б. будет настаивать на
том, что на участке фиброина, используемого в нашей экзаменационной подборке
присутствуют альфа-спирали, то это может вызвать негативную реакцию
потенциальных заказчиков, т.к. степень кругового дихроизма для раствора, в
котором присутствуют только такие участки, измерена. Вывод этих измерений
совпадает с данными других авторов, которые исследовали этот фиброин другими
методами. Я же Вам писал, что использую только участки хорошо изученные, где
есть совпадение разных методов. Мы же с Вами не в игрушки в конце-концов
играем...
Жду исправленных и проверенных на моделях целых белков данных. Повторение
структур типа AA - заведомо неверный результат. По проверенным данным все
участки разные (один участок A, один участок B, и один участок C). И не
забудьте о подтверждении данных лично Л.Б. иначе Вам придется за него и заказы
для фармацевтических и других био-фирм выполнять. Если Вы, как Вы утверждаете,
не биолог, то я Вам в этой ситуации не завидую.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
П: Уважаемый Александр Юрьевич!
1. Вы предложили начать наш контакт с проверки верности предсказаний вторичных
структур. Причем наличие результата Л.Б. Меклера было Вашим условием
представления для сравнения Ваших данных и РСА. Данные Л.Б. Меклера Вы
получили, но, увы, Вашего результата и результата РСА, обещанного Вами, все еще
нет.
K: Мои данные, которые совпадают с данными РСА - это правильный ответ, который
я покажу, когда Вы пришлете корректные данные Л.Б. Меклера. Пока что я получил
лишь одну треть данных в корректрой форме, а именно:
N3-B.
Кстати, как выглядят мои данные Вы уже видели. Для напоминания вкладываю их
снова в это письмо.
Остальные данные (N1-?, N2-?) в корректной форме я до сих пор от Вас не получил.
Если Вы настаиваете, чтобы я зачислил Ваш ответ (N1-A, N2-A), как заведомо
неверный, то на какой результат экзамена Вы рассчитываете? Мне не трудно Вам
повторить, что по данным РСА все три белка имеют разные структуры. Если Вы не
хотите исправлять свои данные, то о правильном решении задачи фолдинга
Л.Б.Меклером не может быть и речи.
У меня создается впечатление, что Вы не заинтересованы в заказах
фармацевтических фирм, о которых было написано в Вашем первом письме.
Если бы мне сказали: предскажешь структуры трех типов белков, - получишь
признание и, возможно, заказы фармацевтических фирм, то я бы не стал настаивать
на том, чтобы мне сначала правильный ответ в виде данных РСА прислали. Ведь
потенциальные заказчики это могут "неправильно" истолковать...
П: 2.По поводу Вашего высказывания; "Я бы не стал предлагать Л.Б.Меклеру
участок фиброина, если бы не был уверен в том, что именно на этом участке
процент альфа-спирализации строго равен нулю, т.к. на этом участке нет ни одной
альфа-спирали по данным из разных источников" обращаю Ваше внимание, что это
явное недоразумение.
Нигде в нашем тексте не говорилось что в фиброине есть альфа - спирали. Любой,
кто обратится в Протеин дейта банк увидит , что в опубликованных там моделях
трехмерных молекул белков, установленных методами РСА и ЯМР анализа,
содержатся следующие широко известные регулярные структуры - альфа-спираль,
спираль 3/10, пи -спираль, бета - структура, бета и гамма-изгибы, а также
омега-петли и иные не структурированные области, так называемые, rendom coils,
а такая структура как "цикл" не числится.
K: Вы, вероятно, не обратили внимание на мое пояснение, что "циклом" я назвал
участок белка, в котором не содержатся альфа-спирали и последний остаток
участка химически соединен с первым, т.е. по существу образует цикл. Если в
модели Л.Б.Меклера этого участка (C) конец и начало окажутся так же далеки друг
от друга, как в структуре прямого участка фиброина или альфа-структурного белка,
то сами понимаете, что о точности трехмерного предсказания будет говорить
трудно. Если же Л.Б. не заметит образования ковалентной связи между последним и
первым АО в пептиде C, то как же он замечает водородные связи?
Что касается Вашего утверждения: "Нигде в нашем тексте не говорилось, что в
фиброине есть альфа-спирали", то как трактовать Вашу фразу: "Первый пептид
покажет 80% альфаспирализации, второй пептид - 60% альфаспирализации, 40 % бета
-структуры, третий пептид - около 75% бета - структуры".
Получается, что в фиброине нет альфа-спиралей, но бета-структура составляет
75%? Причем речь идет об участке, про который я Вам уже сообщил, что он
представляет собой 100%-ную бета-структуру. Либо я что-то не понимаю, либо Вы
аккуратнее обращайтесь с цифрами, иначе у меня появится желание еще больше
упростить экзамен.
П: В каждой трехмерной молекуле содержится либо одна, либо несколько регулярных
структур. В данном случае принципиально важно, что на долю структурированных
областей никогда не приходится 100 % всех аминокислотных остатков данной
трехмерной молекулы. Большая или меньшая часть построена из rendom coils.
Величина "меньше" приходится на долю неструктурированных участков и она
различна для различных молекул.
K: Постарайтесь сосредоточиться. Я говорю лишь о трех участках, длиной по 20
аминокислотных остатков. Именно эти три участка (A,B,C) фигурируют в моих
вопросах и отсутсвуют в Ваших ответах. Если вместо ответа на поставленный
вопрос: "Какой из трех участков представляет собой непрерывную альфа-спираль
без включений бета-структуры, какой представляет собой непрерывную
бета-структуру без включений альфа-спиралей, а какой имеет химическую связь
между последним и первым остатком" Вы будете мне рассказывать о том, какие
бывают белки, то вместо положительной оценки за экзамен придется поставить
отрицательную.
Помните анекдот, который я Вам уже рассказывал: "Ежик, спички нужны? - Нет.
А я принес!"
Поймите Вы, наконец, что Ваши рассказы о процентах альфа-спирализации целого
белка не несут информации о структуре его части, имеющей длину 20 АО.
Вместо рассказов о свойствах целого белка Вы дайте конкретный ответ:
N1-?
N2-?
И чтобы их структуры не были одной и той же структурой A. Я Вам уже сказал,
что это заведомо неверный ответ. Я за свои слова отвечаю. Как только я получу
комплект из трех разных букв и подтверждение, что это результат научного
прогноза Л.Б.Меклера, а не предположение не биолога П.Л.Червонобродова, то
сразу же пришлю данные РСА, и если Вам действительно интересно, то и свои.
П: Фиброин шелка - это бета-структура, перемежающаяся неструктурированными
участками, необходимыми для присущей фиброину шелка гибкости.
Поэтому третий пептид согласно П-К коду представляет собой структуру, в
которой из 29 ее аминокислотных остатков аминокислотные остатков №№ 76,
77 78 и 104 не структурированы, а остальные представляют собой бета-структуру,
на долю коорой согласно спектру КД соответствующего раствора данного пептида,
зарегистрированного при соответствующей температуре придется примерно 75% ее
аминокислотных остатков ( предсказание данной теории)
K: -Давайте закончим с фиброином. Вы прислали ответ (N3-B). Это значит, что Вам
нужно прислать еще две буквы (А,С), которые к фиброину не относятся. Давайте
закончим экзамен, а потом, если будет желание обсудим фиброины, керотины,
лизоцимы и пр.
П: Желающие могут синтезировать данный пептид и, выполнив перечисленные выше
процедуры, убедиться. что это предсказание верно.
K: Может быть оно и верно, но в наш экзамен вопрос о процентном содержании
структур в целых белках не входит. Речь идет лишь о конкретных коротких
участках, структура которых надежно определена разными методами. Обсудить их Вы
сможете после экзамена.
П: Ранее говорилось, повторю - Л.Б.Меклер может обучить желающих, даже не
биологов, построить структуру фрагмента белка, если он автономен, с
использованием П-К кода.
K: - Это - тоже после экзамена. Я надеюсь, что Вы понимаете, что от результатов
этого экзамена напрямую зависит желание ознакомиться с методикой Л.Б.Меклера.
Если экзамен будет сдан, то желание будет большим, а если провален, то
маленьким...
П: Что касается международного конкурса, то Л.Б. Меклер готов в нем участвовать
хоть сегодня, но по правилам, а именно: для конкурса представляются
последовательности аминокислотных остатков, трехмерные структуры которых не
опубликованы и хранятся до опубликования и сравнения с моделью, представляемой
участником конкурса.
Если У Вас есть рентгеноскописты или ЯМР анализаторы, которые готовы представить
такие объекты, они могут обратиться к Л.Б.Меклеру, в том числе через Вас. Это и
будет настоящий международный конкурс.
K: - Я могу Вас поздравить с участием в настоящем международном конкурсе, т.к.
последовательности, которые я Вам предоставил в качестве экзаменационных,
трехмерные структуры которых не опубликованы на нашем сервере, будут
опубликованы сразу после получения недостающих данных от Л.Б.Меклера.
П: То же самое справедливо и в отношении иностранной фирмы. В этом случае
необходимы название, адрес, тел. и электронный адрес фирмы.
С уважением Павел Червонобродов.
K: Что касается фирм из китая, то первая фирма из Гон-Конга прислала мне письмо
по-английски, а я английский знаю не на много лучше китайского, поэтому могу
Вам прислать содержание письма. Может быть Вы поможете мне его перевести на
русский? Что касается адреса и названия фирмы, то я спрошу их разрешения.
Представители второй фирмы из Китая сегодня приезжали ко мне. Их точно
интересуют белки (можете послушать фрагмент наших переговоров(фонограмму), т.к.
эта часть несекретная).
Они сказали, что подождут конца экзамена. Если Л.Б.Меклер правильно построит
хотя бы два белка из трех, то будет предмет для разговора. При следующей
встрече (они должны принести проект контракта с нашей лабораторией) я могу
спросить разрешение прислать Вам их реквизиты. Я думаю, что они дадут
разрешение, если результат экзамена им понравится. А если нет, то какой смысл?
С уважением и надеждой, что рано или поздно Вы пришлете корректные данные,
которые мы вместе с Вами сравним с РСА.
Ваш Кушелев
nanoworld@bigfoot.com
20020126 07.30
Уважаемый Павел Леонович!
Упрощаю формулировку экзаменационных вопросов.
На участке "A" РСА "видит" единственную альфа-спираль, длиной 20 АО.
На участке "С" РСА "не видит" ни одной альфа-спирали. Между последним и первым
АО имеется химическая связь.
По данным Л.Б.Меклера:
N1 ?
N2 ?
N3 B
Отсутствие однозначного ответа в следующем письме я буду расценивать как провал
Л.Б.Меклером экзамена.
С Уважением,
Ваш Кушелев
nanoworld@bigfoot.com
20020126 15.00
П: Уважаемый Александр Юрьевич!
Надо ли пояснять, что означает "автономный пептид" в составе белковой молекулы?
Если не надо, то сообщите, пожалуйста, являются ли предложенные Вами пептиды
автономными.
С уважением Павел Червонобродов.
K: A,B,C - не пептиды, а именно участки целых белков. Вы стали называть их
пептидами, но это уже на Ваше усмотрение. Последовательности целых белков у Вас
есть. Варианты ответов - есть. Время на обдумывание - есть. Может быть у меня
что-то с головой, и я действительно дал Вам неполные данные?
С уважением, Ваш Кушелев
nanoworld@bigfoot.com
20020127 10.30
П:Тема: Re: А.Кушелеву: Окончательный ответ. 26.01.02
Уважаемый Александр Юрьевич!
После исправления ошибки ответ Л.Б. Меклера:
N1 А
N2 С
N3 B
Пояснения следующие:
Поскольку в составе данного фрагмента есть два АО цистеина, следует проверить
могут ли эти два цистеина образовать между собой С-С связь. Согласно теории
формирования, функционирования и эволюции биополимеров и ОСГК С-С связи между
цистеинами биополипептидов образуются только в том случае, если система А-А
связей между АО, прилежащими к остаткам цистеинов, ставит эти цистеины в
соответсвующую суперпозицию, по отношению друг к другу. Ниже показано, что это
условие выполняется в отношении остатков цистеинов - компонентов данного
фрагмента. Видим, что целый частокол А-А связей и П-К связей приводит эти
остатки цистеина в суперпозицию друг к другу, что в свою очередь и приводит к
образованию между ними С-С связей.
91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106
A D A V A C A K R V V R D P Q G
I p I I I I p p / / p k
G D R N G C P N R W A V W A R I
122 120 118 116 114 112 110 108 107
Условные обозначения:
I / - А-А связь p - П-К связь k - ковалентная связь
С уважением
Ваш Павел Червонобродов.
K: Примите мои поздравления!
Все Ваши данные приняты к оценке.
В течение дня будет подведен предварительный итог экзамена.
Заранее могу сказать, что Ваше объяснение:
"...С-С связи между цистеинами биополипептидов образуются..."
является совершенно правильным. Именно Cys117 образует
химическую связь (дисульфидный мостик) с Cys96 в структуре
лизоцима. Именно этот фрагмент белка мы демонстрируем потенциальным
заказчикам и спонсорам в качестве примера работы программы CASP.exe
Именно этот фрагмент Cys96-Cys117 используется в качестве иллюстрации
в нашей научной статье о композиционном генетическом коде.
Вы можете посмотреть его трехмерное изображение по адресу:
http://ftp.decsy.ru/nanoworld/DATA/IMAGES/SLIDES/990709/demo.htm
Если Вы по техническим причинам не можете выйти на наш сервер, то
можно посмотреть эту структуру все-равно, т.к. я вкладываю ее в это письмо.
Я сейчас попробую посмотреть, на каком расстоянии находятся АО 91-121, и
могут ли между ними образоваться связи, как показано на схеме Л.Б.Меклера.
Уже сейчас я могу сказать, что один из трех белков Вы определили правильно.
Остальные предсказания будут известны сегодня в течение дня.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com
20020127
Тема: Подведение предварительных результатов экзамена Л.Б.Меклера
Меклер РСА Название белка
N1 А B fibroin
N2 С С human lysozyme
N3 B A S.tendae alpha-amylase inhibitor
Предварительные результаты изображены на сводной таблице:
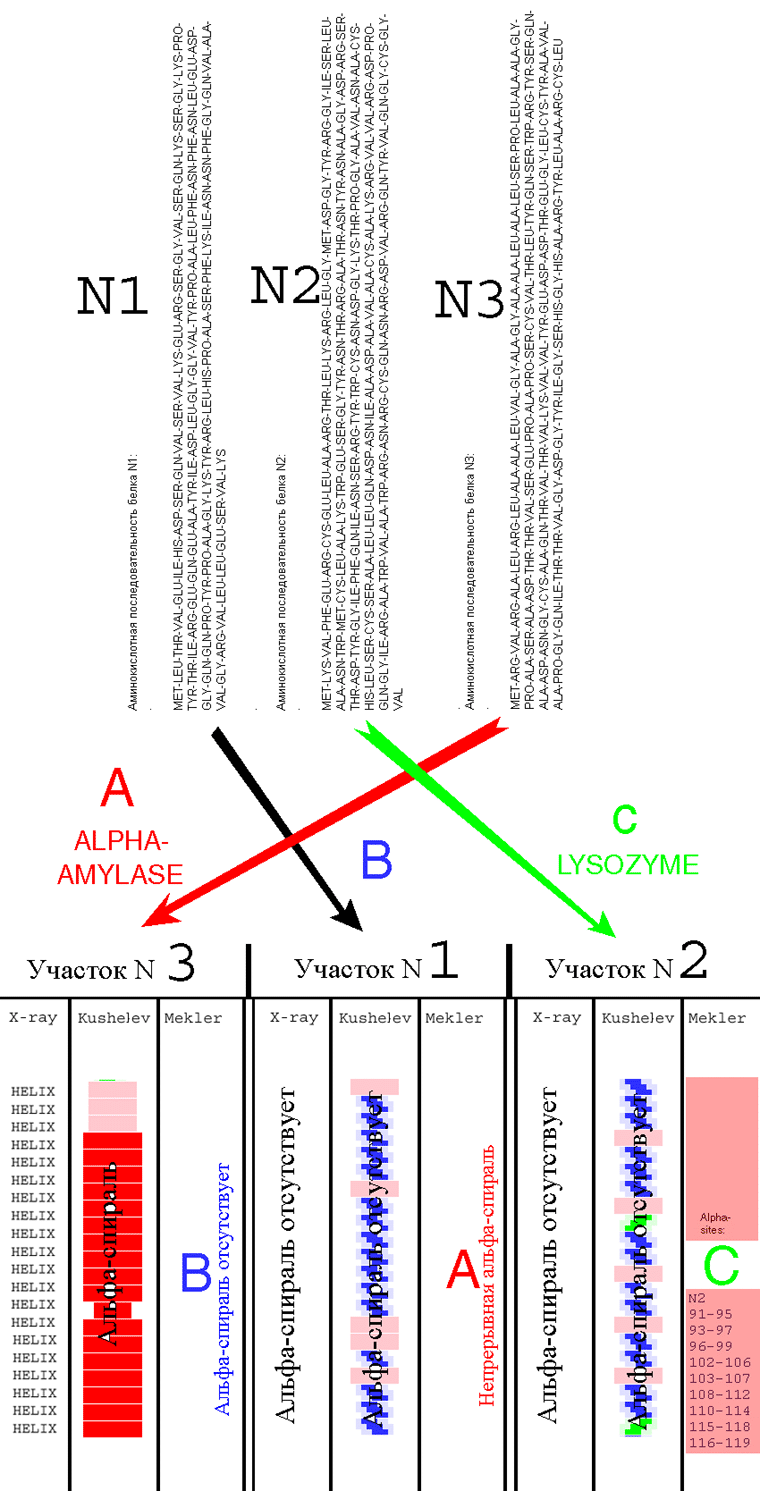 Я правильно понимаю, что по данным Л.Б.Меклера, как и по данным РСА связь
Cys96-Cys117 образуется, но в отличие от РСА Л.Б.Меклер утверждает, что
участок лизоцима Cys96-Cys117 содержит 9 альфа-спиралей? По данным РСА
на этом участке лизоцима нет ни одной альфа-спирали.
Участок белка N2 Перечень альфа-спиралей по Л.Б.Меклеру
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
Участок N2. По данным РСА альфа-спиралей нет.
Представитель китайской фирмы попросил меня, чтобы Л.Б. Меклер объяснил расхождение
данных по лизоциму. Химическая связь определена Л.Б. Меклером правильно, но вторичная,
а значит и третичная структура не соответствует данным РСА. Значит ли это, что
данные Л.Б. Меклера могут расходиться с данными РСА, показывая практически
непрерывную альфа-спираль на всем участке (20 АО), в то время как по данным РСА
на этом участке не встречается ни одной альфа-спирали?
А я хотел бы услышать объяснение, почему участок альфа-амилазы, длиной 20 АО
Л.Б. интерпретировал, как фиброин, т.е. отсутствие альфа-спиралей, а
участок фиброина, в котором нет ни одной альфа-спирали (по данным самого Л.Б.)
он интерпретировал как непрерывную альфа-спираль?
Ответы Л.Б.Меклера на эти вопросы будут непременно опубликованы на нашем сервере,
поэтому просьба отнестись к ним с полной ответственностью.
С уважением,
Ваш Александр Кушелев
Я правильно понимаю, что по данным Л.Б.Меклера, как и по данным РСА связь
Cys96-Cys117 образуется, но в отличие от РСА Л.Б.Меклер утверждает, что
участок лизоцима Cys96-Cys117 содержит 9 альфа-спиралей? По данным РСА
на этом участке лизоцима нет ни одной альфа-спирали.
Участок белка N2 Перечень альфа-спиралей по Л.Б.Меклеру
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
Участок N2. По данным РСА альфа-спиралей нет.
Представитель китайской фирмы попросил меня, чтобы Л.Б. Меклер объяснил расхождение
данных по лизоциму. Химическая связь определена Л.Б. Меклером правильно, но вторичная,
а значит и третичная структура не соответствует данным РСА. Значит ли это, что
данные Л.Б. Меклера могут расходиться с данными РСА, показывая практически
непрерывную альфа-спираль на всем участке (20 АО), в то время как по данным РСА
на этом участке не встречается ни одной альфа-спирали?
А я хотел бы услышать объяснение, почему участок альфа-амилазы, длиной 20 АО
Л.Б. интерпретировал, как фиброин, т.е. отсутствие альфа-спиралей, а
участок фиброина, в котором нет ни одной альфа-спирали (по данным самого Л.Б.)
он интерпретировал как непрерывную альфа-спираль?
Ответы Л.Б.Меклера на эти вопросы будут непременно опубликованы на нашем сервере,
поэтому просьба отнестись к ним с полной ответственностью.
С уважением,
Ваш Александр Кушелев
Тема: Работа над ошибками 20020127 14.40
Здравствуйте, Павел Леонович!
Предварительные результаты экзамена можно посмотреть на нашем сайте по адресу:
http://www.nanoworld.narod.ru
Раздел "Конкурс по белкам".
Если Вам не удастся зайти на наш сайт, то можете прочитать текстовую часть материала,
которую я копирую с сайта и вставляю в текст этого письма:
20020126 14.00
Тема: Подведение предварительных результатов экзамена Л.Б.Меклера
Меклер РСА Название белка
N1 А B fibroin
N2 С С human lysozyme
N3 B A S.tendae alpha-amylase inhibitor
Предварительные результаты изображены на сводной таблице:
см. вложенный файл-картинку
Я правильно понимаю, что по данным Л.Б.Меклера, как и по данным РСА связь
Cys96-Cys117 образуется, но в отличие от РСА Л.Б.Меклер утверждает, что
участок лизоцима Cys96-Cys117 содержит 9 альфа-спиралей? По данным РСА
на этом участке лизоцима нет ни одной альфа-спирали.
Участок белка N2 Перечень альфа-спиралей по Л.Б.Меклеру
91-95
93-97
96-99
102-106
103-107
108-112
110-114
115-118
116-119
Участок N2. По данным РСА альфа-спиралей нет.
Представитель китайской фирмы попросил меня, чтобы Л.Б. Меклер объяснил расхождение
данных по лизоциму. Химическая связь определена Л.Б. Меклером правильно, но вторичная,
а значит и третичная структура не соответствует данным РСА. Значит ли это, что
данные Л.Б. Меклера могут расходиться с данными РСА, показывая практически
непрерывную альфа-спираль на всем участке (20 АО), в то время как по данным РСА
на этом участке не встречается ни одной альфа-спирали?
А я хотел бы услышать объяснение, почему участок альфа-амилазы, длиной 20 АО
Л.Б. интерпретировал, как фиброин, т.е. отсутствие альфа-спиралей, а
участок фиброина, в котором нет ни одной альфа-спирали (по данным самого Л.Б.)
он интерпретировал как непрерывную альфа-спираль?
Ответы Л.Б.Меклера на эти вопросы будут непременно опубликованы на нашем
сервере, поэтому просьба отнестись к ним с полной ответственностью.
С уважением,
Ваш Александр Кушелев
nanoworld@bigfoot.com

20020128 21.17 Тема: Работа над ошибками.
CD N1: http://ftp.decsy.ru/nanoworld/index.htm
NanoWorld 2002: http://ftp.decsy.ru/nanoworld2002/index.htm
|

